题目内容
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
(2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列 (填这些物质的序号),其中CA3、GA3在常温、常压下都是气体,但CA3比GA3易液化,其主要原因是 。
(3)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净L(可用于合成氨反应的催化剂)的表面上存在C原子,右图为C原子在L的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表L原子)。则在图示状况下,L颗粒表面上L/C原子数之比为 。

(4)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是 。

(5)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。
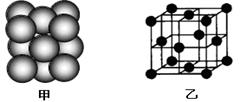
请回答:晶胞中M原子的堆积方式为 ,配位数为 。

(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
(2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列 (填这些物质的序号),其中CA3、GA3在常温、常压下都是气体,但CA3比GA3易液化,其主要原因是 。
(3)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净L(可用于合成氨反应的催化剂)的表面上存在C原子,右图为C原子在L的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表L原子)。则在图示状况下,L颗粒表面上L/C原子数之比为 。

(4)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是 。

(5)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。

请回答:晶胞中M原子的堆积方式为 ,配位数为 。
每空2分,共14分
⑴N>O>C; ⑵ ⑤③④①② ;NH3能形成氢键,沸点高于PH3
⑶2:1; ⑷sp2、sp3;
⑸面心立方最密堆积 12
⑴N>O>C; ⑵ ⑤③④①② ;NH3能形成氢键,沸点高于PH3
⑶2:1; ⑷sp2、sp3;
⑸面心立方最密堆积 12
试题分析:由元素在周期表中的位置可知,A为H,B为C,C为N,D为O,E为Na,M为Al,F为Si,G为P,H为Cl,I为Ar,J为K,L为Fe,K为Co,
(1)N位于ⅤA族,2P轨道排布3个电子,为半充满状态,第一电离能大于O,故第一电离能由大到小的顺序为:N>O>C。
(2)①NH3为分子晶体,②PH3为分子晶体,③NaCl为离子晶体,④KCl为离子晶体,⑤SiO2为原子晶体,熔点为原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大熔点越高但氨气中含氢键,其熔点高于②,离子晶体中离子半径小的晶格能大,熔点高,所以熔点为⑤>③>④>①>②。
(3)小黑色球代表N原子,灰色球代表Fe原子,取Fe为四个顶点的小正方形作为一个单元来研究,Fe原子 被4个同样的小正方形共用, 每个单元含Fe原子4×1/4=1,而相邻的两个小正方形,其中1个正方形的中心为N原子,所以1个小正方形平均含有0.5个N原子,故Fe与N原子数之比为2:1。
(4)C=N中为平面结构,杂化形式为sp2,-NH2中为三角锥结构,杂化形式为sp3。
(5)M位于正方体的顶点和6个面的面心,所以晶胞中M原子的堆积方式为面心立方最密堆积;根据晶胞的立体结构可知配位数为12.。

练习册系列答案
相关题目




 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。



 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。