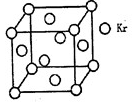
题目内容
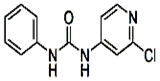
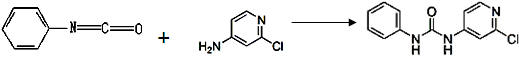
具有光、电、磁等特殊功能的新型材料是目前化学研究的热点之一,二硫醇烯与锌的配合物(C)的一种合成途径如下。

(1)锌原子基态时核外电子排布式为 。
(2)下列说法正确的是 (不定项选择)。
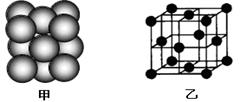
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
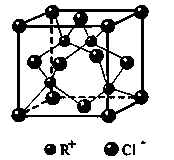
d.硫化钠晶胞(如图所示)中含4个S2-离子

(3)化合物B中CS32-的空间构型是 (用文字描述)
(4)配合物C中Zn2+的配位数是 (填数字),N原子杂化方式是 。
(5)1mol化合物A中含有σ键的数目为 。

(1)锌原子基态时核外电子排布式为 。
(2)下列说法正确的是 (不定项选择)。
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
d.硫化钠晶胞(如图所示)中含4个S2-离子

(3)化合物B中CS32-的空间构型是 (用文字描述)
(4)配合物C中Zn2+的配位数是 (填数字),N原子杂化方式是 。
(5)1mol化合物A中含有σ键的数目为 。
(1)1S22S23S23P63d64S2或[Ar]3d104S2(2)cd; (3)平面正三角形;(4)4;SP3;8NA
试题分析:(1)锌是30号元素,原子核外有30个电子,故其原子基态时核外电子排布式为1s22s23s23p63d104s2。
(2)金属晶体溶点高低与晶格能大小相关,而晶格能与阳离子半径大小和电子数多少有关,由于锂离子半径小,两都自由电子数相同,因此钠的晶格能较上,自然熔点较低。金属钠晶体属于体心立方堆积,由于两者都是分子晶体,相对分子质量越大,分子间作用力越大,所以CS2的沸点比CO2高。d.硫化钠晶胞中S2-离子个数计算为8*1/8+6*1/2=4个,故选CD。
(3)化合物B中CS32-的空间构型是根据价层电子对互斥理论可以得出(4+2)/2=3,故为平面三角形分子。
(4)配合物C中Zn2+的配位数是4,N原子杂化方式是SP3杂化方式,与铵根离子中氮的形式一样。
(5)双键中有一个键是σ键,故1mol化合物A中含有σ键的数目为8mol。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

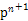 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。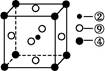



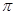 键有 mol。
键有 mol。