题目内容
3.铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: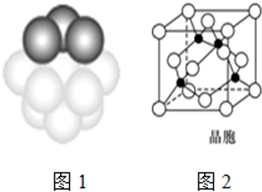
(1)铁在元素周期表中的位置为第四周期第Ⅷ族.
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体(晶体类型).
(3)Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)=Fe(s)+xCO(g).
已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有金属键、极性共价键.
(4)CN-中碳原子杂化轨道类型为sp杂化,1mol CN-中含有π键的数目为2NA.
(5)铜晶体铜原子的堆积方式如图1所示.(面心立方最密堆积)
①基态铜原子的核外电子排布式为ls22s22p63s23p63d104s1.
②每个铜原子周围距离最近的铜原子数目12.
(6)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子,空心圆代表M原子).
①该晶体的化学式为CuCl.
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于共价(填“离子”或“共价”)化合物.
③已知该晶体的密度为ρ g•cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子与M原子之间的最短距离为$\frac{{\sqrt{3}}}{4}$×$\root{3}{{\frac{4×99.5}{{{N_A}×ρ}}}}$cm(只写计算式).
分析 (1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族;
(2)分子晶体的熔沸点较低;
(3)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,根据生成物判断形成的化学键;
(4)根据C原子价层电子对个数确定杂化方式;三键中只有一个西格玛键,其余为π键;
(5)①铜为29号元素,据此写出基态铜原子的核外电子排布式;
②根据晶胞结构图可知,铜为面心立方堆积,据此判断每个铜原子周围距离最近的铜原子数目;
(6)根据价电子排布式判断出X原子为Cl原子;
①利用均摊法计算得出;
②根据电负性差值判断化合物类型;
③计算出一个晶胞中微粒数,利用化合物的摩尔质量和密度计算出晶胞边长,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$;
解答 解:(1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族,故答案为:第四周期第ⅤⅢ族;
(2)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,故答案为:分子晶体;
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe和CO,所以形成的化学键为金属键和极性共价键,故答案为:金属键;极性共价键;
(4)CN-中C原子价层电子对个数=1+$\frac{1}{2}$(4+1-1×3)=2,所以采取sp杂化,碳氮间形成三键,一个西格玛键,2NA个π键,故答案为:sp杂化;2NA;
(5)①铜为29号元素,基态铜原子的核外电子排布式为[Ar]3d104s1 或1s22s22p63s23p63d104s1,故答案为:[Ar]3d104s1 或1s22s22p63s23p63d104s1;
②根据晶胞结构图可知,铜为面心立方堆积,所以每个铜原子周围距离最近的铜原子位于经过该原子的立方体的面的面心上,共有12个,故答案为:12;
(6)根据价电子排布式判断出X原子为Cl原子;
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为CuCl,故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值1.1小于1.7,形成共价键,故答案为:共价;
③一个晶胞的摩尔质量为4×99.5g/mol,晶胞摩尔体积为$\frac{4×99.5}{g}$cm3,晶胞的边长为$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$,而体对角线为晶胞边长的$\sqrt{3}$倍,所以铜原子和M原子之间的最短距离为$\frac{{\sqrt{3}}}{4}$×$\root{3}{{\frac{4×99.5}{{{N_A}×ρ}}}}$cm,故答案为:$\frac{{\sqrt{3}}}{4}$×$\root{3}{{\frac{4×99.5}{{{N_A}×ρ}}}}$.
点评 本题考查较为全面,涉及到电子排布式、第一电离能、杂化类型的判断、配合物以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在2 mol/L FeBr2溶液80 mL中通入4.48 L氯气(标况下),充分反应:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |