题目内容
13. “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.
已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值增大(填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,该反应这一时刻向右进行(填“左”或“右”).
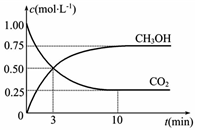
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-49.0KJmol-1,某温度下,向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①反应开始至平衡,氢气的平均反应速率v(H2)=0.225mol•(L•min)-1,CO2的转化率为75%.
该温度下上述反应的平衡常数K=$\frac{16}{3}$.
②反应达到平衡后,下列能使$\frac{{c(C{H_3}OH)}}{{c(C{O_2})}}$的值增大的措施是bd填符号
a.升高温度 b.再充入H2 c.再充入CO2 d.将H2O(g)从体系中分离 e.充入He(g)
③新型高效的甲醇CH3OH燃料电池采用Pt为电极材料,两个电极上分别通入CH3OH和O2,KOH溶液为电解质,是写出上述电池负极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子2mol.
分析 (1)①升高温度平衡向吸热方向移动,根据平衡移动的方向判断平衡常数K值变化;
②计算浓度商,与平衡常数比较,可判断反应是否达到平衡状态;
(2)①根据CO2和CH3OH(g)的浓度随时间的变化的图示,先根据甲醇的浓度变化计算出消耗的氢气的浓度,再计算出氢气的平均反应速率;根据三行式求各组分的物质的量浓度,然后根据表达式计算;
②要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
③燃料电池负极上市燃料失电子的氧化反应,据此书写发生反应的电极反应式;氧气的物质的量为:0.5mol,而1mol氧气转移4mol电子,由此分析解答.
解答 解:(1)①反应吸热,升高温度平衡向正反应方向移动,则高炉内CO2和CO体积比值增大,平衡常数K值增大,
故答案为:增大;
②1100℃时测得高炉中c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,在这种情况下,浓度商Qc=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.025mol/L}{0.1mol/L}$=0.25<0.263,所以此时反应未达到化学平衡,反应向着正向进行,正反应速率大于逆反应速率;
故答案为:右;
(2)①根据图示可知,10min达到平衡状态,甲醇浓度为0.75mol/L,由反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)可知,消耗氢气的浓度为:0.75mol/L×3=2.25mol/L,氢气平均反应速率为:$\frac{2.25mol/L}{10min}$=0.225mol/(L•min),
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
c(初):1 3 0 0
c(变):0.75 2.25 0.75 0.75
c(平):0.25 0.75 0.75 0.75
所以CO2的转化率为$\frac{0.75}{1}×100%$=75%,K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,
故答案为:0.225;75%;$\frac{16}{3}$;
②n(CH3OH)/n(CO2)增大,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)向着正向移动,
a.升高温度,该反应放热,升高温度,平衡向着逆向移动,n(CH3OH)/n(CO2)减小,故错误;
b.再充入H2,平衡向着正向移动,n(CH3OH)/n(CO2)增大,故正确;
c.再充入CO2,平衡向着正向移动,但是二氧化碳浓度增加的大于甲醇增大浓度,n(CH3OH)/n(CO2)减小,故错误;
d.将H2O(g)从体系中分离,平衡向着正向移动,n(CH3OH)/n(CO2)增大,故正确;
e.充入He(g),各组分浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故错误;
故答案为:bd;
③燃料电池负极上是燃料失电子的氧化反应,发生反应的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,氧气的物质的量为:0.5mol,而1mol氧气转移4mol电子,所以转移电子的物质的量为2mol,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;2.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 | |
| B. | 点燃氢气前,先检验氢气的纯度 | |
| C. | 加热液体时,试管口不对着人 | |
| D. | 利用丁达尔效应区别胶体和溶液 |
| A. | 水分子间存在氢键,所以水常温下以液态存在并且化学性质非常稳定 | |
| B. | 常温、常压下以液态存在的物质一定都是由分子构成,因此该液体一般无法导电 | |
| C. | 硫酸钾在熔融状态下离子键被削弱,形成定向移动的离子,从而导电 | |
| D. | 冰醋酸晶体溶于水的过程中即破坏了分子间作用力,也破坏了部分分子内作用力 |
| A. | 氢氧化钠 | B. | 盐酸 | C. | 水煤气 | D. | 氯化钠溶液 |
| A. | NH4+、K+、CO32-、Cl- | B. | Al3+、Cu2+、S2-、Cl- | ||
| C. | NH4+、Cu2+、Cl-、NO3- | D. | Fe3+、K+、SCN-、NO3- |
| A. | 石油分馏的目的是获得乙烯、丙烯和丁二烯 | |
| B. | 减少SO2的排放,可以从根本上消除雾霾 | |
| C. | 食品工业利用液态二氧化碳代替有机溶剂,能避免有机溶剂污染食品 | |
| D. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 |
| A. | Fe3O4溶于足量稀 HNO3 中:Fe3O4+8H+═Fe2++ZFe3++4H2O | |
| B. | NH4HCO3溶液与足量 NaOH 溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 将过量的 SO2 通入 NaClO 溶液中:SO2+ClO-+H2O═HClO+HSO3- | |
| D. | 将 0.2mol•L-1KA1(SO4)2 溶液与 0.3mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| A. | 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 | |
| B. | 乙醇、乙酸均能与NaOH反应.是因为分子中均含有官能团“-OH” | |
| C. | 分子式为C6H12且碳碳双键在链端的烯烃共有6种异构体 | |
| D. | 分子式为C4H7ClO2的羧酸可能有5种 |