题目内容
12.下列有关 Na2SO3溶液的叙述不正确的是( )| A. | 该溶液中,K+、CO32-、Br-、ClO-能大量共存 | |
| B. | 不能用稀硝酸酸化的硝酸钡溶液检验该溶液是否变质 | |
| C. | 将此溶液与稀硫酸产生的少量气体通入足量的NaAlO2溶液中制Al(OH)3:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32- | |
| D. | 能使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
分析 A.次氯酸根离子具有强氧化性,能氧化亚硫酸根离子;
B.稀硝酸具有氧化性也能氧化亚硫酸钠为硫酸钠;
C.亚硫酸酸性大于氢氧化铝,少量二氧化硫和偏铝酸钠溶液反应生成氢氧化铝沉淀和亚硫酸钠;
D.亚硫酸钠具有还原性,在酸性溶液中还原高锰酸钾为锰离子,亚硫酸根离子被氧化为硫酸根离子.
解答 解;A.次氯酸根离子具有强氧化性,在碱性溶液中能氧化亚硫酸根离子,ClO-不能大量共存,故A错误;
B.稀硝酸具有氧化性也能氧化亚硫酸钠为硫酸钠,用稀硝酸酸化的硝酸钡溶液生成的沉淀不知是亚硫酸钠变质后的硫酸根离子生成还是稀硝酸氧化亚硫酸钠生成的硫酸根离子结合钡离子生成,故B正确;
C.将此溶液与稀硫酸产生的少量气体为二氧化硫气体,通入足量的NaAlO2溶液中反应生成Al(OH)3和亚硫酸钠,反应的离子方程式为:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32-,故C正确;
D.亚硫酸钠具有还原性,在酸性溶液中还原高锰酸钾为锰离子,亚硫酸根离子被氧化为硫酸根离子,反应的离子方程式为:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故D正确;
故选A.
点评 本题考查了氧化还原反应实质、反应产物判断、离子方程式书写等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
5.硼在化合物中一般显正价.可用下述方法合成储氢材料氨硼烷:LiBH4+NH4Cl=NH3BH3+LiCl+H2↑.NH3BH3在催化剂存在时可以与水发生催化脱氢反应:NH3BH3+2H2O$\frac{\underline{\;催化剂\;}}{\;}$NH4BO2+3H2↑.下列有关说法正确的是( )
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
20.“电池新贵”铝电池是用石墨作为正极材料,用有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作为电解液的二次电池,电池充电快、容量高、成本低、也很安全.已知该电池工作的过程中不产生其他离子且有机阳离子不参与电极反应,则下列说法正确的是( )
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
7.向0.1mol/L的NH4HCO3溶液中逐滴加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数).根据图象,下列说法不正确的是( )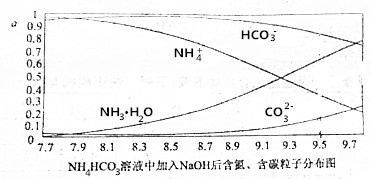

| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
4.下列有关说法不正确的是( )
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
1.氮化钛(Ti3N4)为金黄色晶体,是市售仿金品的重要成份.以TiCl4为原料,经过一系列反应(见图1)可以制得Ti3N4和纳米TiO2.
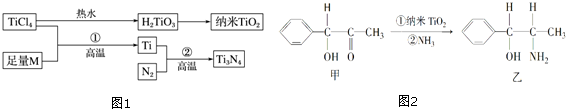
①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
M是Mg (填元素符号),该金属晶体的堆积模型为A3型最密堆积又称六方最密堆积.
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.

①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
2.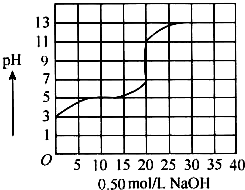 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
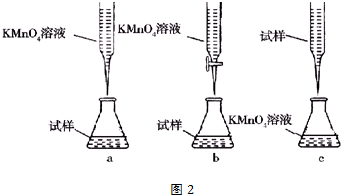
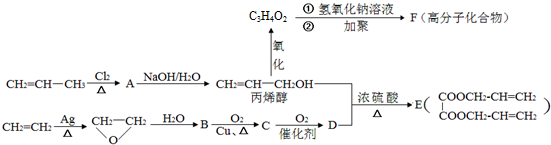
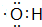 ;丙烯→A的反应类型为取代反应.
;丙烯→A的反应类型为取代反应.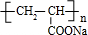 .
.