题目内容
2.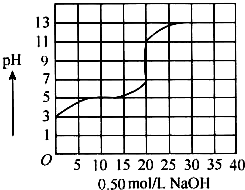 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
分析 从图中可以看出,用NaOH滴定盐酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,而且用去NaOH的体积是20mL,盐酸滴定前的浓度是20×0.50/100=0.10(mol/L),因为滴定前该酸的pH=3;若为弱酸,溶液在稀释过程中会继续电离,所以pH小于4,根据变色范围选择指示剂.
解答 A、依据图象分析开始时,盐酸的PH=3,从图中可以看出,用NaOH滴定该弱酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,而且用去NaOH的体积是20 mL,该弱酸滴定前的浓度是20×$\frac{0.5}{100}$=0.10mol/L,故A错误;
B、因为滴定前该盐酸的pH=3,稀释10倍后pH为4,故B正确;
C、从图中可以看出,用NaOH滴定该弱酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,但也可以用甲基橙,故C错误;
D、若用酚酞作指示剂,滴定终点时溶液颜色的变化为无色到粉红色,故D错误;
故选B.
点评 本题考查了酸碱中和反应的终点判断和图象分析判断,指示剂的选择原则,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列有关 Na2SO3溶液的叙述不正确的是( )
| A. | 该溶液中,K+、CO32-、Br-、ClO-能大量共存 | |
| B. | 不能用稀硝酸酸化的硝酸钡溶液检验该溶液是否变质 | |
| C. | 将此溶液与稀硫酸产生的少量气体通入足量的NaAlO2溶液中制Al(OH)3:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32- | |
| D. | 能使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
13.某小组同学在实验室中研究+2和+3价铁的硝酸盐的化学性质.
(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?[Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
①步骤i溶液中反应的离子方程式是2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确,溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强.
(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?[Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确,溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强.
10.在下列条件下,一定能大量共存的离子组是( )
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
17.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
7.下列说法不正确的是( )
| A. | 高纯度二氧化硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 家用“84”消毒液可用来漂白衣物,为了增强漂白效果,可加入浓盐酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用来保鲜水果 | |
| D. | 加热能杀死甲型 H1N1流感病毒是因为蛋白质受热变性 |
14.某有机物分子式为C5H10O2,既能氢氧化钠溶液又能发生银镜反应的链状同分异构体有几种( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.如图为一种微生物燃料电池工作原理示意图,关于该电池叙述正确的是( )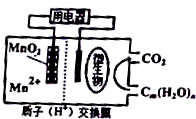

| A. | 在高温下使用更利于微生物发挥作用 | |
| B. | 每生成1molCO2转移4mole- | |
| C. | 放电过程中,质子通过交换膜从左侧移到右侧 | |
| D. | 负极反应式为:Mn2++2H2O-2e-=MnO2+4H+ |
 甲醇、乙醇、氨气等都是重要的化工原料.
甲醇、乙醇、氨气等都是重要的化工原料.