题目内容
Na2SO3是一种重要化工原料.
(1)向1.0moL/L的Na2SO3溶液中滴加酚酞,溶液变为红色.用离子方程式解释其原因 .
(2)工业上Na2SO3可用于吸收烟气中的SO2.将烟气通入1L 1.0mol/L的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO4的能力显著下降,应对吸收剂进行处理.
①当该吸收剂吸收了8.96L SO2(换算成标准状况),此时溶液中c(CO32-):c(HSO3-)= .
②如图为不同脱硫剂和不同浓度的Na2SO3对脱硫效率的影响.

下列说法中,正确的是 .
a.Na2SO3浓度越高脱硫效率越高
b.相同条件下,四种脱硫剂中NaOH的脱硫效率最高
c.对于相同浓度的Na2SO3溶液,温度越高脱硫效率越高
d.当溶液pH约为6时,此时所得溶液的溶质只有NaHSO2
③溶液吸收能力下降后,进行加热再生,同时得到浓的SO2.加热再生的化学方程式是 .
(1)向1.0moL/L的Na2SO3溶液中滴加酚酞,溶液变为红色.用离子方程式解释其原因
(2)工业上Na2SO3可用于吸收烟气中的SO2.将烟气通入1L 1.0mol/L的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO4的能力显著下降,应对吸收剂进行处理.
①当该吸收剂吸收了8.96L SO2(换算成标准状况),此时溶液中c(CO32-):c(HSO3-)=
②如图为不同脱硫剂和不同浓度的Na2SO3对脱硫效率的影响.

下列说法中,正确的是
a.Na2SO3浓度越高脱硫效率越高
b.相同条件下,四种脱硫剂中NaOH的脱硫效率最高
c.对于相同浓度的Na2SO3溶液,温度越高脱硫效率越高
d.当溶液pH约为6时,此时所得溶液的溶质只有NaHSO2
③溶液吸收能力下降后,进行加热再生,同时得到浓的SO2.加热再生的化学方程式是
考点:二氧化硫的污染及治理,盐类水解的应用
专题:元素及其化合物
分析:(1)亚硫酸钠溶液中,亚硫酸根离子部分水解生成亚硫酸氢根离子和氢氧根离子,溶液显示碱性;
(2)①计算出二氧化硫的物质的量,再根据反应方程式计算出反应后的溶液中c(CO32-):c(HSO3-);
②根据题干中两个图象的数据及曲线的变化进行判断;
③亚硫酸钠加热分解生成亚硫酸钠、二氧化硫和水,据此写出反应的化学方程式.
(2)①计算出二氧化硫的物质的量,再根据反应方程式计算出反应后的溶液中c(CO32-):c(HSO3-);
②根据题干中两个图象的数据及曲线的变化进行判断;
③亚硫酸钠加热分解生成亚硫酸钠、二氧化硫和水,据此写出反应的化学方程式.
解答:
解:(1)向1.0moL/L的Na2SO3溶液中,由于亚硫酸根离子水解生成亚硫酸氢根离子和氢氧根离子,溶液显示碱性,则滴加酚酞,溶液变为红色,反应的离子方程式为:SO32-+H2O?HSO3-+OH-,
故答案为:SO32-+H2O?HSO3-+OH-;
(2)①标况下8.96L SO2的物质的量为:
=0.4mol,
1L 1.0mol/L的Na2SO3溶液中含有亚硫酸钠的物质的量为:1.0mol/L×1L=1mol,根据反应SO32-+H2O+SO2=2HSO3-可知,0.4mol二氧化硫与0.4mol亚硫酸钠完全反应生成0.8mol亚硫酸氢根离子,亚硫酸钠还剩余0.6mol,则此时溶液中c(SO32-):c(HSO3-)=0.6mol:0.8mol=3:4,
故答案为:3:4;
②a.根据右边图象可知,时间相同时,Na2SO3浓度越高脱硫效率越高,故a正确;
b.根据左边图象可知,相同条件下,相同时间段,四种脱硫剂中NaOH的脱硫效率最高,故b正确;
c.根据题中图象可知,无法判断温度对脱硫效率的影响,故c错误;
d.当溶液pH约为6时,此时所得溶液的溶质主要为NaHSO3,溶液中还有亚硫酸存在,故d错误;
故答案为:ab;
③溶液吸收能力下降后,进行加热再生,同时得到浓的SO2,亚硫酸钠加热分解的化学方程式为:2NaHSO3
Na2SO3+SO2↑+H2O,
故答案为:2NaHSO3
Na2SO3+SO2↑+H2O.
故答案为:SO32-+H2O?HSO3-+OH-;
(2)①标况下8.96L SO2的物质的量为:
| 8.96L |
| 22.4L/mol |
1L 1.0mol/L的Na2SO3溶液中含有亚硫酸钠的物质的量为:1.0mol/L×1L=1mol,根据反应SO32-+H2O+SO2=2HSO3-可知,0.4mol二氧化硫与0.4mol亚硫酸钠完全反应生成0.8mol亚硫酸氢根离子,亚硫酸钠还剩余0.6mol,则此时溶液中c(SO32-):c(HSO3-)=0.6mol:0.8mol=3:4,
故答案为:3:4;
②a.根据右边图象可知,时间相同时,Na2SO3浓度越高脱硫效率越高,故a正确;
b.根据左边图象可知,相同条件下,相同时间段,四种脱硫剂中NaOH的脱硫效率最高,故b正确;
c.根据题中图象可知,无法判断温度对脱硫效率的影响,故c错误;
d.当溶液pH约为6时,此时所得溶液的溶质主要为NaHSO3,溶液中还有亚硫酸存在,故d错误;
故答案为:ab;
③溶液吸收能力下降后,进行加热再生,同时得到浓的SO2,亚硫酸钠加热分解的化学方程式为:2NaHSO3
| ||
故答案为:2NaHSO3
| ||
点评:本题考查了二氧化硫的污染及治理、盐的水解原理的应用等知识,题目难度中等,注意掌握二氧化碳的性质、污染及治理方法,明确盐的水解原理,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
第二届青奥会“幸福之门”火炬用铝合金材料制造.铝合金属于 ( )


| A、盐 | B、氧化物 |
| C、纯净物 | D、混合物 |
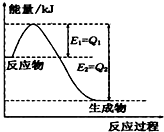 (1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:
(1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为: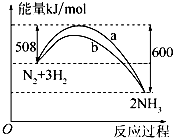 化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.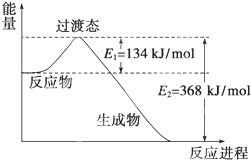 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
 ⑤O2与O3
⑤O2与O3