题目内容
A为某短周期非金属元素的单质,常用作电极材料及润滑剂.将其与铁片等如图I组装好,通电一段时间后,溶液颜色变浅,请回答:

(1)A极发生的电极反应式是 .
(2)停止通电,从图I装置中取出铁电极,用蒸馏水清洗干净后,投入盛有过量稀硫酸的烧杯中,如图Ⅱ所示.
①反应开始后的现象是 .
②若使反应速率减慢,可采取的操作是 (选填字母).
a.加入少量水 b.加入少量CH3COONa固体 c.通入少量HCl气体
(3)已知在强碱性环境中,Fe(OH)3可与NaClO溶液作用而生成FeO42-.
①此反应的离子方程式是 ,
②若反应中生成10mol水,则电子转移数是 mol.

(1)A极发生的电极反应式是
(2)停止通电,从图I装置中取出铁电极,用蒸馏水清洗干净后,投入盛有过量稀硫酸的烧杯中,如图Ⅱ所示.
①反应开始后的现象是
②若使反应速率减慢,可采取的操作是
a.加入少量水 b.加入少量CH3COONa固体 c.通入少量HCl气体
(3)已知在强碱性环境中,Fe(OH)3可与NaClO溶液作用而生成FeO42-.
①此反应的离子方程式是
②若反应中生成10mol水,则电子转移数是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)A为某短周期非金属元素的单质,常用作电极材料及润滑剂,则A为石墨,用石墨作阳极、Fe作阴极电解氯化铜溶液时,阳极上氯离子放电、阴极上铜离子放电;
(2)①将铁电极通入稀硫酸中,该装置构成原电池,Fe易失电子作负极、Cu作正极,正极上氢离子得电子发生还原反应,负极上铁溶解;
②反应速率与氢离子浓度成正比,要使反应速率降低,应该使氢离子浓度减小;
(3)①碱性条件下,次氯酸钠和氢氧化铁发生氧化还原反应生成氯离子、高铁酸根离子和水;
②根据水和转移电子之间的关系式计算.
(2)①将铁电极通入稀硫酸中,该装置构成原电池,Fe易失电子作负极、Cu作正极,正极上氢离子得电子发生还原反应,负极上铁溶解;
②反应速率与氢离子浓度成正比,要使反应速率降低,应该使氢离子浓度减小;
(3)①碱性条件下,次氯酸钠和氢氧化铁发生氧化还原反应生成氯离子、高铁酸根离子和水;
②根据水和转移电子之间的关系式计算.
解答:
解:(1)A为某短周期非金属元素的单质,常用作电极材料及润滑剂,则A为石墨,用石墨作阳极、Fe作阴极电解氯化铜溶液时,阳极上氯离子放电、阴极上铜离子放电,所以A极电极反应式为2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)①将铁电极通入稀硫酸中,该装置构成原电池,Fe易失电子作负极、Cu作正极,正极上氢离子得电子发生还原反应,负极上铁溶解,所以看到的现象是红色部分冒出大量气泡,铁片被腐蚀,无色溶液变成浅绿色,故答案为:红色部分冒出大量气泡,铁片被腐蚀,无色溶液变成浅绿色;
②反应速率与氢离子浓度成正比,要使反应速率降低,应该使氢离子浓度减小,
a.加水稀释能降低氢离子浓度,从而降低反应速率,故正确;
b.加入醋酸钠固体时,硫酸和醋酸钠反应生成醋酸,醋酸是弱电解质,则溶液中氢离子浓度降低,反应速率减小,故正确;
c.通入氯化氢气体,溶液中氢离子浓度增大,则反应速率加快,故错误;
故选ab;
(3)①碱性条件下,次氯酸钠和氢氧化铁发生氧化还原反应生成氯离子、高铁酸根离子和水,离子反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②反应2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中,每生成5mol水转移电子3mol,则生成10mol水,转移电子的物质的量为6mol,故答案为:6.
(2)①将铁电极通入稀硫酸中,该装置构成原电池,Fe易失电子作负极、Cu作正极,正极上氢离子得电子发生还原反应,负极上铁溶解,所以看到的现象是红色部分冒出大量气泡,铁片被腐蚀,无色溶液变成浅绿色,故答案为:红色部分冒出大量气泡,铁片被腐蚀,无色溶液变成浅绿色;
②反应速率与氢离子浓度成正比,要使反应速率降低,应该使氢离子浓度减小,
a.加水稀释能降低氢离子浓度,从而降低反应速率,故正确;
b.加入醋酸钠固体时,硫酸和醋酸钠反应生成醋酸,醋酸是弱电解质,则溶液中氢离子浓度降低,反应速率减小,故正确;
c.通入氯化氢气体,溶液中氢离子浓度增大,则反应速率加快,故错误;
故选ab;
(3)①碱性条件下,次氯酸钠和氢氧化铁发生氧化还原反应生成氯离子、高铁酸根离子和水,离子反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②反应2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中,每生成5mol水转移电子3mol,则生成10mol水,转移电子的物质的量为6mol,故答案为:6.
点评:本题考查了原电池原理和氧化还原反应、化学反应速率的影响因素等知识点,明确原电池和电解池电极上发生的反应、氧化还原反应中元素化合价变化即可解答,注意(2)①中装置能构成原电池,为易错点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
用下列实验装置或操作进行相应实验,能达到实验目的是( )
A、 用如图装置验证化学能转化为电能 |
B、 用如图所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
C、 用如图装置制备氢氧化亚铁 |
D、 利用如图装置证明酸性:CH3COOH>H2CO3>苯酚 |
某抗酸药每片含碳酸钙534mg,氢氧化镁180mg,每片该抗酸药可中和溶质质量分数为6.2%的盐酸( )
| A、8 g |
| B、10 g |
| C、18 g |
| D、无法计算 |


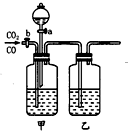 为将CO2和CO进行分离并得到干燥的CO2和CO,现设计一套装置(如图).
为将CO2和CO进行分离并得到干燥的CO2和CO,现设计一套装置(如图).