题目内容
在相同的温度和容积不变时,能说明反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已知达到平衡状态的是( )
| A、n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1 |
| B、容器内压强保持不变 |
| C、H2的消耗速率与CH3OH的消耗速率之比为3:1 |
| D、容器内的密度保持不变 |
考点:化学平衡状态的判断
专题:
分析:可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
解答:
解:A.平衡时各物质物质的量之比决定于开始加入物质的多少和反应限度,与平衡状态无关,所以n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1,不能判断正逆反应速率是否相等,无法判断是否达到平衡状态,故A错误;
B.该反应是体积减小的反应,容器内压强保持不变,表明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故B正确;
C.当H2的消耗速率与CH3OH的消耗速率之比为3:1时才能表示正逆反应速率,且满足计量数关系,说明达到了平衡状态,故C错误;
D.容器内的密度保持不变,反应方程式两边都是气体,气体的总质量不变,容器的容积固定,所以反应过程中气体的密度始终不变,所以密度不能作为判断平衡状态的依据,故D错误;
故选B.
B.该反应是体积减小的反应,容器内压强保持不变,表明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故B正确;
C.当H2的消耗速率与CH3OH的消耗速率之比为3:1时才能表示正逆反应速率,且满足计量数关系,说明达到了平衡状态,故C错误;
D.容器内的密度保持不变,反应方程式两边都是气体,气体的总质量不变,容器的容积固定,所以反应过程中气体的密度始终不变,所以密度不能作为判断平衡状态的依据,故D错误;
故选B.
点评:本题考查了化学平衡状态的判断,注意平衡时反应特点是正逆反应速率相等各组分浓度不再变化,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
往NH4Cl溶液加入少量Na2O固体,溶液中颗粒的数目不变的是( )
| A、NH4+ |
| B、H+ |
| C、Cl- |
| D、H2O |
下列各组离子一定能大量共存的是( )
| A、无色透明溶液中:Ca2+、H+、Cl-、Fe2+ |
| B、能与金属铝反应发出氢气的溶液:K+、NO3-、Cl-、Fe3+ |
| C、由水电离出的c(H+)=1.0×10-12mol/L的溶液:Na+、Cu2+、HCO3-、NO3- |
| D、KW/c(H+)=0.1mol/L的溶液中:Na+、K+、CO32-、NO3- |
对H2O的电离平衡不产生影响的粒子是( )
A、 | ||
B、
| ||
C、 | ||
D、 |
钛合金被誉为二十一世纪的金属,具有广泛的用途.金属钛可用下列方法提炼:
①TiO2+2C+2Cl2
TiCl4+2CO ②TiCl4+2Mg
2MgCl2+Ti
对上述两个反应,下列有关叙述正确的是( )
①TiO2+2C+2Cl2
| ||
| ||
对上述两个反应,下列有关叙述正确的是( )
| A、反应①中Cl2是还原剂 |
| B、反应①中碳元素被还原 |
| C、反应②中钛元素被氧化 |
| D、反应②中TiCl4是氧化剂 |
有关热化学反应描述正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B、CO(g)的燃烧热是283.0kJ/mol,则有下列热化学方程式:2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol |
| C、需要加热才能发生的反应一定是吸热反应 |
| D、1mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
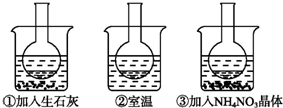 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体. 某种燃料电池的工作原理示意如图所示,a、b均为惰性电极.
某种燃料电池的工作原理示意如图所示,a、b均为惰性电极.