题目内容
3.现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).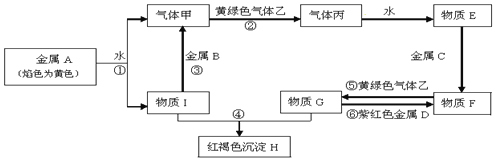
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:BAl;FFeCl2 HFe(OH)3;
(2)写出反应①的离子方程式:2Na+2H2O=2Na++2OH-+H2↑写出反应⑥的离子方程式:2Fe3++Cu=2Fe2++Cu2+;
(3)气体乙与SO2气体都具有漂白性,将等体积的气体乙和SO2通入到水中,得到的溶液是否具有漂白性?否(填“是”或“否”).反应的化学方程式Cl2+SO2+2H2O=2HCl+H2SO4.
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀H为Fe(OH)3;
由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,I为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;
G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,结合物质的性质解答该题.
解答 解:(1)由以上分析可知B为Al,F为FeCl2,H为Fe(OH)3,故答案为:Al; FeCl2;Fe(OH)3;
(2))①钠和水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,⑥为Cu和铁离子的氧化还原反应生成亚铁离子和铜离子,离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Fe3++Cu=2Fe2++Cu2+;
(3)二氧化硫与氯气发生氧化还原反应生成硫酸和盐酸,不具有漂白性,不能用于漂白,方程式为Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:否;Cl2+SO2+2H2O=2HCl+H2SO4.
点评 本题以无机框图题的形式考查Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系、化学用语的书写、离子检验等,侧重于学生的分析能力和元素化合物知识的综合运用的考查,难度中等,注意把握物质之间转化的特点,尤其是物质反应的典型现象,注意基础知识的掌握.

练习册系列答案
相关题目
19.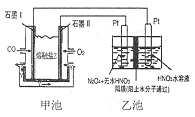 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )| A. | 石墨I是原电池的负极,发生氧化反应 | |
| B. | 甲池中的CO32-向石墨I极移动 | |
| C. | 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| D. | 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol |
20.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA | |
| D. | 14g分子式为C3H6的链烃中含有的C-H键的数目为2NA |
18.某些高温油炸食品含有丙烯酰胺.过量的丙烯酰胺可引起食品安全问题.关于丙烯酰胺叙述不正确的是( )
| A. | 能使酸性KMnO4溶液褪色 | B. | 能发生加聚反应 | ||
| C. | 能与乙醇发生酯化反应 | D. | 能与氢气发生加成反应 |
8.下列实验装置、试剂选用或操作正确的是( )
| A. |  稀释浓硫酸 | B. |  吸收氨气 | C. |  石油的分馏 | D. |  除去CO2中的HCl |
15.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| B | 区分碳酸钠和碳酸氢钠两种溶液 | 用氢氧化钡溶液分别滴加,观察现象 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
13.M是一种化工原料,可以制备一系列物质(见如图).
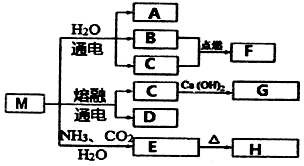
下列说法正确的是( )

下列说法正确的是( )
| A. | 元素C、D形成的简单离子半径,前者大于后者 | |
| B. | F的热稳定性比H2S弱 | |
| C. | 化合物A、F中化学键的类型相同 | |
| D. | 元素C、D的最高价氧化物的水化物均可以和H发生反应 |