题目内容
请回答下列问题:
(1)NH4Cl溶液显 性,原因是 (用离子方程式表示),NH4Cl溶液中离子浓度由大到小的顺序为 .
(2)常温下,0.10mol/L的CH3COOH溶液中,c(H+) 0.10mol/L(填“>”、“<”、“=”).
CH3COOH在水溶液中的电离方程式为
(3)将浓度均为0.10mol/L的CH3COOH溶液和NaOH溶液混合后,若pH>7,则该溶液中c(CH3COO-) c(Na+).(填“>”、“<”、“=”).
(1)NH4Cl溶液显
(2)常温下,0.10mol/L的CH3COOH溶液中,c(H+)
CH3COOH在水溶液中的电离方程式为
(3)将浓度均为0.10mol/L的CH3COOH溶液和NaOH溶液混合后,若pH>7,则该溶液中c(CH3COO-)
考点:盐类水解的原理,弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)氯化铵溶液中铵根离子水解显酸性,据此比较离子浓度大小;
(2)CH3COOH是弱电解质,部分电离CH3COOH?CH3COO-+H+;
(3)根据电荷守恒来分析解答.
(2)CH3COOH是弱电解质,部分电离CH3COOH?CH3COO-+H+;
(3)根据电荷守恒来分析解答.
解答:
解:(1)氯化铵溶液中铵根离子水解显酸性,NH4Cl溶液显酸性,水解离子方程式为:NH4++H2O=NH3?H2O+H+;溶液中离子浓度由大到小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:酸;NH4++H2O=NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COOH是弱电解质,部分电离,所以0.10mol/L的CH3COOH溶液中,c(H+)<0.10mol/L,电离方程式为CH3COOH?CH3COO-+H+,故答案为:<;CH3COOH?CH3COO-+H+;
(3)0.10mol/L的CH3COOH溶液和NaOH溶液混合,电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),又因为c(H+)<c(OH-),所以c(CH3COO-)<c(Na+),故答案为:<.
故答案为:酸;NH4++H2O=NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COOH是弱电解质,部分电离,所以0.10mol/L的CH3COOH溶液中,c(H+)<0.10mol/L,电离方程式为CH3COOH?CH3COO-+H+,故答案为:<;CH3COOH?CH3COO-+H+;
(3)0.10mol/L的CH3COOH溶液和NaOH溶液混合,电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),又因为c(H+)<c(OH-),所以c(CH3COO-)<c(Na+),故答案为:<.
点评:本题考查盐类水解的分析应用,溶液PH的大小比较离子浓度的大小,题目难度不大,注意盐类的水解程度大小,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学式为C5H12O的有机物,经测定知其分子中含有两个-CH3,两个-CH2-,一个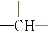 和一个-OH,则它们的可能结构有( )
和一个-OH,则它们的可能结构有( )
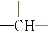 和一个-OH,则它们的可能结构有( )
和一个-OH,则它们的可能结构有( )| A、5种 | B、3种 | C、2种 | D、4种 |
在某无色透明的且能使石蕊试剂变红的溶液中,能大量共存的离子组是( )
| A、K+、SO42-、HCO3- |
| B、K+、SO42-、NO3- |
| C、Fe2+、Cl-、NO3- |
| D、Fe3+、ClO-、Cl- |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温下,1molCl2与足量NaOH溶液完全反应,转移的电子数2NA |
| B、常温常压下,32g氧气和臭氧混合气体中所含有的氧原子数为2NA |
| C、标准状况下,22.4L水所含原子数为3NA |
| D、同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
下列装置图或曲线图与对应的叙述相符的是( )
A、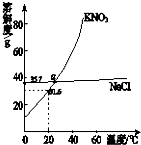 固体KNO3中混有NaCl,可用重结晶进行提纯 |
B、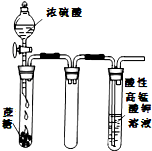 酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
C、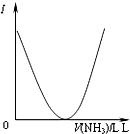 可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D、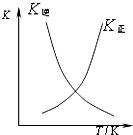 可表示在恒容密闭容器中反应“2SO2(g)+O2(g)═2SO3(g)△H<0”的平衡常数K正、K逆随温度 |
据报道,锌-空气电池将会成为21世纪理想动力源.在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2=2Na2ZnO2+2H2O,下列有关锌-空气电池说法正确的是( )
| A、每生成1mol Na2ZnO2转移4mol电子 |
| B、负极反应式为:Zn+4OH--2e-=ZnO22-+2 H2O |
| C、电池工作时,溶液中的Na+向负级移动 |
| D、碱性或酸性电解液中,该电池正极反应式相同 |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
| C、某温度时,1L pH=6的纯水中含有1.0×10-6NA个H+ |
| D、28g铁粉与足量Cl2反应时转移的电子数为NA |