题目内容
下列装置图或曲线图与对应的叙述相符的是( )
A、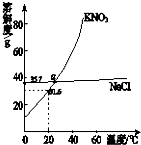 固体KNO3中混有NaCl,可用重结晶进行提纯 |
B、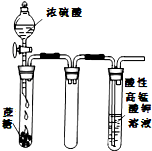 酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
C、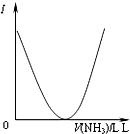 可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D、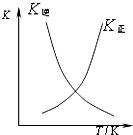 可表示在恒容密闭容器中反应“2SO2(g)+O2(g)═2SO3(g)△H<0”的平衡常数K正、K逆随温度 |
考点:化学平衡常数的含义,电解质在水溶液中的电离,浓硫酸的性质,物质的分离、提纯和除杂
专题:
分析:A、NaCl受温度影响溶解度变化不大,而硝酸钾受温度影响溶解度变化很大,所以固体KNO3中混有NaCl,可用重结晶进行提纯;
B、浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性;
C、乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质;
D、温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大.
B、浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性;
C、乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质;
D、温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大.
解答:
解:A、由图可知,NaCl受温度影响溶解度变化不大,而硝酸钾受温度影响溶解度变化很大,所以固体KNO3中混有NaCl,可用重结晶进行提纯,故A正确;
B、浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性,二氧化碳微溶于水,溶液中有气泡,故B错误;
C、乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质,溶液导电性增强,故C错误;
D、温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大,故D错误.
故选A.
B、浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性,二氧化碳微溶于水,溶液中有气泡,故B错误;
C、乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质,溶液导电性增强,故C错误;
D、温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大,故D错误.
故选A.
点评:本题较为综合,侧重于溶解度、元素混合物知识、电解质以及化学平衡等问题的考查,题目难度中等,注意把握平衡常数的意义.

练习册系列答案
相关题目
下列不属于盐类水解反应离子方程式的是( )
| A、HCO3-+H2O?H3O++CO32- |
| B、CH3COO-+H2O?CH3COOH+OH- |
| C、CO32-+H2O?HCO3-+OH- |
| D、Al3++3H2O?Al(OH)3+3H+ |
下列说法不正确的是( )
| A、活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 |
| B、同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等 |
| C、将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成 |
| D、将足量Cl2通入NaBr、NaI的混合溶液中,反应后将溶液蒸干并充分灼烧,剩余的固体物质成分为NaCl |
下列各组物质,属于电解质是( )
| A、熔融NaCl | B、铜 |
| C、酒精 | D、硫酸溶液 |
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中氧化剂与还原剂的物质的量之比是( )
| A、1:1 | B、3:8 |
| C、2:3 | D、8:3 |
1gN2O含a个分子,则阿伏加德罗常数可表示为( )
A、
| ||
| B、a mol-1 | ||
| C、44a mol-1 | ||
D、
|
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝.烤蓝时发生如下反应:下列说法中正确的是( )
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH.
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH.
| A、Fe3O4既可看做是氧化物,又可看做是铁盐 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |