题目内容
按图示操作进行实验,下列实验现象、解释均正确的是( )
| 选项 | 实验试剂 | 现象 | 解释 | 实验操作 |
| A | 试剂1:5%的H2O2溶液 试剂2:酸性KI淀粉溶液 | 溶液变蓝 | I--被H2O2氧化成I2,I2遇淀粉变蓝 |  |
| B | 试剂1:SO2的水溶液 试剂2:滴有酚酞的NaOH溶液 | 溶液褪色 | SO2具有漂白性,将酚酞漂白 | |
| C | 试剂1:乙醇 试剂2:酸性KMnO4溶液 | 溶液褪色 | 乙醇将KMnO4还原,自身被氧化为乙醛 | |
| D | 试剂1:FeCl3溶液 试剂2:待检溶液 | 溶液变红 | 待检溶液中含有SCN-,与Fe3+反应生成红色的[Fe(SCN)6]4- |
考点:化学实验方案的评价
专题:实验评价题
分析:A.过氧化氢具有强氧化性,可氧化KI生成碘,淀粉遇碘变蓝色.
B.二氧化硫不能漂白酸碱指示剂;
C.乙醇被酸性高锰酸钾氧化生成乙酸;
D.产物错误,应生成[Fe(SCN)2]+或[Fe(SCN)3等.
B.二氧化硫不能漂白酸碱指示剂;
C.乙醇被酸性高锰酸钾氧化生成乙酸;
D.产物错误,应生成[Fe(SCN)2]+或[Fe(SCN)3等.
解答:
解:A.过氧化氢具有强氧化性,可氧化KI生成碘,淀粉遇碘变蓝色,故A正确.
B.二氧化硫可与水反应生成亚硫酸,与氢氧化钠发生中和反应,不能漂白酸碱指示剂,故B错误;
C.乙醇被酸性高锰酸钾氧化生成乙酸,乙醛也被酸性高锰酸钾氧化,则不能生成乙醛,故C错误;
D.产物错误,应生成[Fe(SCN)2]+或[Fe(SCN)3等,故D错误.
故选A.
B.二氧化硫可与水反应生成亚硫酸,与氢氧化钠发生中和反应,不能漂白酸碱指示剂,故B错误;
C.乙醇被酸性高锰酸钾氧化生成乙酸,乙醛也被酸性高锰酸钾氧化,则不能生成乙醛,故C错误;
D.产物错误,应生成[Fe(SCN)2]+或[Fe(SCN)3等,故D错误.
故选A.
点评:本题考查化学实验方案的评价,为高频考点,涉及离子检验、反应类型以及物质的性质,侧重物质性质及反应原理的考查,注意方案的合理性、评价性分析,题目难度不大.

练习册系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的最高正价与最低负价的代数和为零,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.则有关说法正确的是( )
| A、元素A、C、D的单质均能与E的单质反应,且反应均为放热反应 |
| B、元素D的最高价氧化物与B、C、E的最高价氧化物对应的水化物之间均能发生反应 |
| C、化合物AE与CE含有相同类型的化学键 |
| D、元素B、D分别与E形成的化合物中每个原子最外层均满足8电子的稳定结构 |
用下列装置进行相应实验,能达到实验目的是( )
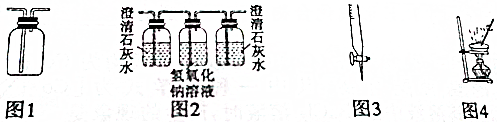

| A、用图1所示装置可以收集H2、NH3、CO2、NO2等气体 |
| B、用图2所示装置可以验证SO2气体中含有CO2气体 |
| C、用图3所示仪器可以量取Na2CO3溶液 |
| D、用图4所示装置可以进行硫酸铜晶体中结晶水含量的测定 |
下列各组离子一定能大量共存的是( )
| A、在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B、在能与Si反应产生H2的溶液中:NH4+、K+、SO32-、NO3- |
| C、在能与Al反应产生H2的溶液中:NH4+、Al3+、SO42-、NO3- |
| D、在pH=1的溶液中:K+、Fe3+、Cl-、NO3- |
 实验室合成乙酸乙酯粗产品的步骤如下:
实验室合成乙酸乙酯粗产品的步骤如下: 有100mL NaOH溶液,现向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求:
有100mL NaOH溶液,现向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: (提示:环丁烷
(提示:环丁烷 可简写成
可简写成 )
)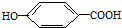 ),其反应类型
),其反应类型 金属铁及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
金属铁及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题: