题目内容
17.将铁和氧化铁的混合物2.72g加入50mL 1.6mol/L的盐酸中,恰好完全反应,滴入KSCN溶液后不显红色,若忽略化学反应中溶液体积的变化,则在所得的溶液中,Fe2+的物质的量浓度为( )| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.8mol/L | D. | 1.6mol/L |
分析 Fe、Fe2O3的混合物与盐酸恰好完全反应,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,根据氯离子守恒可知2n(FeCl2)=n(HCl),再根据c=$\frac{n}{V}$计算.
解答 解:Fe、Fe2O3的混合物与盐酸恰好完全反应,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,
根据氯离子守恒可知2n(FeCl2)=n(HCl)=0.05L×1.6mol/L=0.08mol,所以n(FeCl2)=0.04mol,
故溶液中n(Fe2+)=n(FeCl2)=0.04mol,溶液中Fe2+的物质的量浓度为:$\frac{0.04mol}{0.05L}$=0.8mol/L,
故选C.
点评 本题考查混合物的有关计算、物质的量浓度有关计算,题目难度中等,判断反应生成氯化亚铁是关键,注意根据守恒法进行计算,试题培养了学生的化学计算能力.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
8.下列关于铁的叙述不正确的是( )
| A. | 工业上用铁槽车装运冷浓硝酸是因为铁与冷的浓硝酸不反应 | |
| B. | 在人体的血红蛋白中含有铁元素 | |
| C. | 铁在潮湿的空气中会生锈 | |
| D. | 铁能在氧气中剧烈燃烧 |
5.短周期主族元素A、B、C、D的原子序数依次增大,并且A、B、C原子的最外层电子数之和为14,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:C>B>A | |
| B. | A与其它3种元素均能形成共价化合物 | |
| C. | 室温下,A、C、D的最简单氢化物溶于水形成的水溶液pH都小于7 | |
| D. | 元素B、C、D各自最高和最低化合价的代数和分别为2、4、6 |
12.下表为元素周期表的短周期部分.
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有4 种不同伸展方向的电子云,最外层共有7 种不同运动状态的电子.
(2)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;b、c 两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为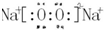 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,
(4)相同条件下,0.1mol/L 盐R中c(ca4+)小于(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+).
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL-35mL)间发生的离子方程式:NH4++OH-=NH3•H2O.若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
| a | |||||||
| b | c | d | |||||
| e | f | g | h |
(1)h原子核外有4 种不同伸展方向的电子云,最外层共有7 种不同运动状态的电子.
(2)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;b、c 两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为
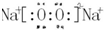 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,
(4)相同条件下,0.1mol/L 盐R中c(ca4+)小于(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+).
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL-35mL)间发生的离子方程式:NH4++OH-=NH3•H2O.若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
2.反应4A(g)+5B(s)═4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为( )
| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.090mol/(L•s) |
9.离子方程式Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O不能表示( )
| A. | Ca(HCO3)2溶液与NaOH溶液反应 | B. | NaHCO3溶液与澄清石灰水反应 | ||
| C. | KHCO3溶液与澄清石灰水反应 | D. | Ca(HCO3)2溶液与澄清石灰水反应 |
6.下列有关硝酸化学性质的叙述中,正确的是( )
| A. | 敞口放置的浓硝酸浓度变小是因为浓硝酸的吸水性 | |
| B. | 硝酸可与Na2SO3反应制得SO2气体 | |
| C. | 浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色 | |
| D. | 硝酸能与Fe2O3反应,表现氧化性 |
7.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3含有的分子数为NA | |
| B. | 常温常压下,17gNH3 所含的原子数目为4NA | |
| C. | 1 molCl2与H2O完全反应,转移2NA个电子 | |
| D. | 0.1mol/LNa2CO3溶液中含有的Na+数目为0.2NA |