题目内容
8.下列关于铁的叙述不正确的是( )| A. | 工业上用铁槽车装运冷浓硝酸是因为铁与冷的浓硝酸不反应 | |
| B. | 在人体的血红蛋白中含有铁元素 | |
| C. | 铁在潮湿的空气中会生锈 | |
| D. | 铁能在氧气中剧烈燃烧 |
分析 A.常温下,铁与浓硝酸发生钝化反应是浓硝酸的强氧化性;
B.人体中缺少铁元素会贫血;
C.铁在潮湿的空气中形成原电池反应最后生成铁锈;
D.铁在氧气中剧烈燃烧火星四射生成四氧化三铁,放出大量热量;
解答 解:A.常温下,铁与浓硝酸发生钝化反应,在表面生成一层致密的氧化物膜而阻碍反应的进行,故A错误;
B.人体中缺少铁元素会贫血,在人体的血红蛋白中含有铁元素,则应及时补充铁元素,在人体的血红蛋白中含有铁元素为亚铁离子,故B正确;
C.铁中含杂质碳,在表面形成的电解质溶液中形成原电池反应,铁做负极失电子生成亚铁离子,正极氧气得到电子生成氢氧根离子,形成氢氧化亚铁被空气氧化生成氢氧化铁,分解生成氧化铁铁锈,故C正确;
D.铁在氧气中剧烈燃烧火星四射生成黑色四氧化三铁,放出大量热量,故D正确;
故选A.
点评 本题考查了铁及其化合物性质的分析应用,主要是合金形成、原电池反应的原理理解,注意常温下铁在浓硝酸、浓硫酸发生钝化现象,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列各组离子能在溶液中大量共存的是( )
| A. | Ba2+、H+、SO42-、CO32- | B. | Na+、H+、Cl-、NO3- | ||
| C. | Mg2+、H+、Cl-、OH- | D. | Na+、H+、Cl-、ClO- |
9.下列离子方程式的书写不正确的是( )
| A. | 氧化铁溶于盐酸Fe2O3+6H+═2Fe3++3H2O | |
| B. | Na2CO3溶液滴入盐酸CO32-+H+═HCO3- | |
| C. | NaHCO3溶液和Ca(OH)2溶液等物质的量混合HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| D. | AlCl3溶液滴入氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
6.下列浓度关系正确的是( )
| A. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| B. | Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 等体积等浓度的氨水与盐酸混合后:c(NH4+)=c(Cl-) | |
| D. | 常温下,pH=8.0的NaHCO3溶液中:c(HCO3-)>c(H2CO3)>c(CO32-) |
3.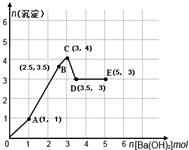 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A. | O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | A→B:2Al3++3SO42-+3Ba2++6OH2-=3BaSO4↓+2Al(OH)3↓ | |
| C. | B→C:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O | |
| D. | D→E:NH4++OH-=NH3•H2O |
20.在恒温恒容的密闭容器中进行反应:X(g)+Y(g)?Z(g),若反应物X的浓度从1mol/L降到0.4mol/L需10s,那么反应物X的浓度由0.4mol/L降到0.1mol/L所需的反应时间为( )
| A. | 5s | B. | 大于5s | C. | 小于5s | D. | 无法判断 |
17.将铁和氧化铁的混合物2.72g加入50mL 1.6mol/L的盐酸中,恰好完全反应,滴入KSCN溶液后不显红色,若忽略化学反应中溶液体积的变化,则在所得的溶液中,Fe2+的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.8mol/L | D. | 1.6mol/L |
18. 双酚A是一种重要的化工原料,它的一种合成路线如图所示:下列说法正确的是( )
双酚A是一种重要的化工原料,它的一种合成路线如图所示:下列说法正确的是( )
丙烯$→_{①}^{HBr}$E$→_{△②}^{NaOH溶液}$F$→_{△,Cu③}^{O2}$G$→_{-H2O}^{苯酚}$双酚A.
 双酚A是一种重要的化工原料,它的一种合成路线如图所示:下列说法正确的是( )
双酚A是一种重要的化工原料,它的一种合成路线如图所示:下列说法正确的是( )丙烯$→_{①}^{HBr}$E$→_{△②}^{NaOH溶液}$F$→_{△,Cu③}^{O2}$G$→_{-H2O}^{苯酚}$双酚A.
| A. | 1mol双酚A最多可与2molBr2反应 | B. | G物质是乙醛的同系物 | ||
| C. | E物质的名称是1-溴丙烷 | D. | 反应③的化学方程式是 :  |