题目内容
6.下列反应的离子方程式书写正确的是( )| A. | 氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
分析 A.反应生成氯化锌和Cu;
B.反应生成硫酸亚铁和氢气;
C.电子、电荷不守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.氯化铜溶液与锌粒反应的离子反应为Cu2++Zn=Zn2++Cu,故A正确;
B.稀 H2SO4与铁粉反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.铁与氯化铁溶液反应的离子反应为Fe+2Fe3+=3Fe2+,故C错误;
D.碳酸钙与盐酸反应的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
16.石墨和锌插入盛稀硫酸的烧杯中,再进行连接,无论形成原电池还是电解池,都不可能发生的电极反应是( )
| A. | 4OH--4e-═O2↑+2H2O | B. | Zn--2e-?Zn 2+ | ||
| C. | O2+2H2O+4e-═4OH- | D. | 2H++2e-═H2↑ |
17.下列有关实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某无色气体通入澄清石灰水中 | 生成白色沉淀 | 该气体一定是CO2 |
| B | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜遇浓硫酸钝化 |
| C | 用洁净的铁丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 该溶液含有Na+,一定不含K+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
1. 某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )
某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )
 某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )
某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N 点所示溶液中 c(CH3COO-)>c(Na+) | |
| C. | Q点消耗NaOH溶液的体积等于醋酸溶液的体积 | |
| D. | M点和N点所示溶液中水的电离程度相同 |
1.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
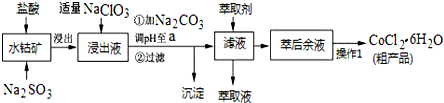
已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
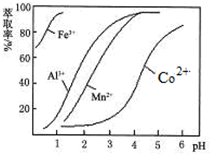
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.
6.下列有关实验操作、现象和结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
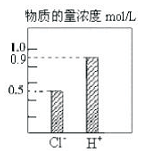 l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
