题目内容
1.某液态环状烃A是重要化工原料,也是工业上常用的有机溶剂.在相同条件下,其蒸气密度是氢气的39倍,完全燃烧7.8g A,将得到的气体产物通入足量的澄清石灰水,得到60g沉淀.请回答下列问题:
(1)A的结构简式是
 ;
;(2)A可与溴单质反应,写出生成A的一溴代物的化学反应方程式
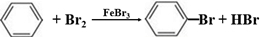 ,A的二溴代物的同分异构体有3种;
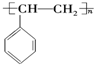
,A的二溴代物的同分异构体有3种;(3)泡沫塑料的主要成分是聚苯乙烯
 ,其单体是
,其单体是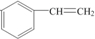 (填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式
(填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式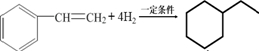 .
.
分析 在相同条件下,其蒸气密度是氢气的39倍,可知有机物的相对分子质量为39×2=78,7.8g A的物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,完全燃烧7.8g A,将得到的气体产物通入足量的澄清石灰水,得到60g沉淀,沉淀为碳酸钙,可知n(C)=c(CaCO3)=$\frac{60g}{100g/mol}$=0.6mol,说明有机物含有6个C原子,结合相对分子质量可知有机物含有N(H)=$\frac{78-12×6}{1}$=6,分子式为C6H6,应为苯,以此解答该题.
解答 解:在相同条件下,其蒸气密度是氢气的39倍,可知有机物的相对分子质量为39×2=78,7.8g A的物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,完全燃烧7.8g A,将得到的气体产物通入足量的澄清石灰水,得到60g沉淀,沉淀为碳酸钙,可知n(C)=c(CaCO3)=$\frac{60g}{100g/mol}$=0.6mol,说明有机物含有6个C原子,结合相对分子质量可知有机物含有N(H)=$\frac{78-12×6}{1}$=6,分子式为C6H6,应为苯,
(1)由以上分析可知有机物为苯,结构简式为 ,故答案为:
,故答案为: ;
;
(2)苯与溴发生取代反应生成溴苯,方程式为 ,苯的二溴代物的同分异构体有邻、间、对3种同分异构体,
,苯的二溴代物的同分异构体有邻、间、对3种同分异构体,
故答案为: ;3;
;3;
(3) 的单体为
的单体为 ,含有苯环和碳碳双键,都可与氢气发生加成反应,方程式为
,含有苯环和碳碳双键,都可与氢气发生加成反应,方程式为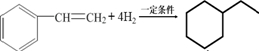 ,
,
故答案为: ;
;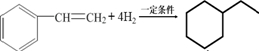 .
.
点评 本题考查有机物的推断,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,本题注意相对密度的应用,把握有机物的结构和性质,难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
11.某烷烃分子的一氯代物有2种,二氯代物有4种的是( )
| A. | 乙烷 | B. | 丙烷 | ||
| C. | 2-甲基丙烷(CH3)3CH | D. | 2,2-二甲基丙烷(CH3)4C |
12.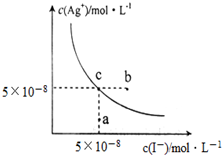 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )| A. | 在t℃时,AgI的Ksp=2.5×10-15 mol2•L-2 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=200 |
9.在水溶液中,因为发生水解反应而不能大量共存的一组微粒是( )
| A. | CO32-、OH-、Na+、H+ | B. | Al3+、Na+、Cl-、AlO2- | ||
| C. | Ba2+、HCO3-、K+、SO42- | D. | S2-、H+、SO42-、Cu2+ |
16.某溶液除水电离出的OH-、H+之外仅含Fe2+、Na+、Al3+、Ba2+、NO3-、SO42-、Cl-中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生.下列说法错误的是( )
| A. | 该溶液中肯定不含Ba2+ | |
| B. | 该溶液中除H+、0H-之外所含离子是Fe2+、Na+、NO3-、SO42- | |
| C. | 若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
11.设NA为阿伏伽德罗常熟的值,下列说法正确的是( )
| A. | 14 g乙烯和丙烯的混合物中总原子数为2NA个 | |
| B. | 在1mol的CH5+中所含的电子数为10NA | |
| C. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| D. | 11.2 L的甲烷气体含有甲烷分子数一定为0.5NA个 |
 ;
;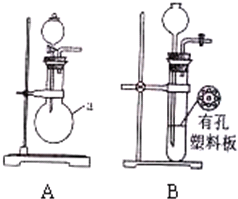 (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.