题目内容
10. (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.(2)用B装置制CO2,使用该装置优点的是随时控制反应的发生和停止.
分析 (1)制备二氧化硫是利用亚硫酸钠和浓硫酸反应生成;
(2)装置B是利用了启普发生器的原理,可以随时进行随时停止.
解答 解:(1)制备二氧化硫是利用亚硫酸钠和浓硫酸反应生成,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)装置B是利用了启普发生器的原理,固体碳酸钙放在塑料板上,从长颈漏斗中加入稀盐酸,浸没碳酸钙反应生成二氧化碳气体,不需要时关闭活塞,随气体生成试管中压强增大,溶液被压入长颈漏斗,液体可以随时进行随时停止,
故答案为:随时控制反应的发生和停止.
点评 本题考查了二氧化硫、二氧化碳制备原理、制备装置和试剂选择等知识,掌握基础是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.以下能级符号不正确的是( )
| A. | 6s | B. | 2d | C. | 3p | D. | 7f |
20.下列反应中属于放热反应的是( )
| A. | Al与盐酸的反应 | |
| B. | 灼热的炭与二氧化碳反应生成一氧化碳 | |
| C. | 石灰石受热分解 | |
| D. | 水分解生成氧气和氢气 |
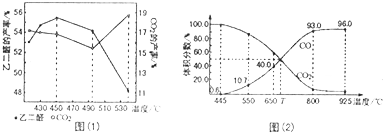
 ;
; ,A的二溴代物的同分异构体有3种;
,A的二溴代物的同分异构体有3种; ,其单体是
,其单体是 (填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式
(填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式 .
. (制酚醛树脂)④
(制酚醛树脂)④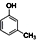 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
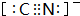 .
.