题目内容
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所 给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | H2SO4 | ClO-+H+=HClO |
| C | Ba2+、HCO3-、Cl-、H+ | Na2SO4 | Ba2++SO42-=BaSO4 |
| D | Al3+、Cl-、NO3-、K+ | 过量NaOH | Al3++3OH-=Al(OH)3↓ |
| A、A | B、B | C、C | D、D |
考点:离子共存问题,离子方程式的书写
专题:离子反应专题
分析:A.离子之间不发生反应,Fe2+可与[Fe(CN)6]2-反应;
B.Fe3+、I-、ClO-发生氧化还原反应;
C.HCO3-、H+不能大量共存;
D.反应生成偏铝酸钠和水.
B.Fe3+、I-、ClO-发生氧化还原反应;
C.HCO3-、H+不能大量共存;
D.反应生成偏铝酸钠和水.
解答:
解:A.离子之间不发生反应,Fe2+可与[Fe(CN)6]2-反应,反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,故A正确;
B.Fe3+、I-、ClO-发生氧化还原反应,不能大量共存,故B错误;
C.HCO3-、H+不能大量共存,生成二氧化碳气体和水,故C错误;
D.该组离子之间不反应,可大量共存,加NaOH发生Al3++4OH-═AlO2-+2H2O,故D错误;
故选A.
B.Fe3+、I-、ClO-发生氧化还原反应,不能大量共存,故B错误;
C.HCO3-、H+不能大量共存,生成二氧化碳气体和水,故C错误;
D.该组离子之间不反应,可大量共存,加NaOH发生Al3++4OH-═AlO2-+2H2O,故D错误;
故选A.
点评:本题考查离子的共存和离子反应,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知由此判断a、b、c、d、e依次为( )
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体,e的一种氧化物具有磁性.
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体,e的一种氧化物具有磁性.
| A、Fe、Cu、Al、Ag、Mg |
| B、Mg、Cu、Al、Ag、Fe |
| C、Al、Cu、Mg、Ag、Fe |
| D、Mg、Ag、Al、Cu、Fe |
化学知识在日常生活中有很多应用,下列说法正确的是( )
| A、用食盐清洗热水瓶中的水垢 |
| B、漂白粉在空气中容易变质的原因是Ca(ClO)2见光分解 |
| C、加碘食盐,能使淀粉显蓝色 |
| D、氯水应避光保存,是因为HClO见光分解 |
下列叙述中正确的是( )
| A、凡是离子化合物在离子方程式中都要以离子来表示 |
| B、离子互换反应总是向着溶液中离子浓度减小的方向进行 |
| C、酸碱中和反应的实质是H+和OH-结合生成水,故酸碱中和反应的离子方程式都是H++OH-=H2O |
| D、复分解反应必须具备离子反应生成的三个条件才能进行 |
溶液中含有NO3-、SO32-、Cl-和NH4+,若向其中加入足量的盐酸,溶液里上述四种离子的浓度基本保持不变的是( )
| A、NO3- |
| B、SO32- |
| C、Cl- |
| D、NH4+ |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,△H>0要使溶液中的c(CH3COO-)提高,并且使电离平衡逆向移动,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
NA代表阿伏加德罗常数,下列有关叙述错误的是( )
| A、1mol 固体NaHSO4含有的阴阳离子总数为2NA |
| B、标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA |
| C、常温常压下,3.4gNH3中含N-H键数目为0.6NA |
| D、56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA |
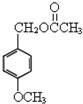 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: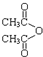 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式: