题目内容
1.下列除去杂质的方法错误的是( )| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | KNO3 | KCl | H2O | 冷却结晶 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氧化铁与盐酸反应,而二氧化硅不能;
B.Al与NaOH溶液发言,而Mg不能;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜;
D.二者溶解度受温度影响不同.
解答 解:A.氧化铁与盐酸反应,而二氧化硅不能,则加足量盐酸、过滤可除杂,故A正确;
B.Al与NaOH溶液发言,而Mg不能,则加足量NaOH溶液、过滤可除杂,故B正确;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜,引入新杂质不能除杂,应选铁粉、过滤,故C错误;
D.二者溶解度受温度影响不同,则加水、冷却结晶可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
11.对任何一个平衡体系采用以下措施,速率改变但平衡一定不移动的是( )
| A. | 加入一种反应物 | B. | 升高温度 | ||
| C. | 对平衡体系增加压强 | D. | 使用催化剂 |
12.以下实验:①为检验RX是碘代烷,将RX与NaOH水溶液混合后再加入AgNO3溶液;②实验室里用无水乙醇和浓硫酸共热至140℃制乙烯;③用锌与稀硝酸反应制取氢气,并用排水法收集氢气;④在试管中加入2mL 10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾;⑤为检验淀粉已水解,将淀粉与少量稀硫酸加热一段时间后再加入银氨溶液,水浴加热;其中可能失败的实验是( )
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ②③⑤ |
16.下列说法正确的是( )
| A. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| B. | 电解精炼铜时,每转移1mol电子,阳极溶解铜的质量为32g | |
| C. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 | |
| D. | 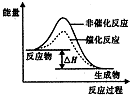 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
6.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为HCO3-+H2O?H2CO3+OH-.
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3.
(2)丙同学认为甲、乙的判断都不充分.丙认为,只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)的判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)的判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3.
(2)丙同学认为甲、乙的判断都不充分.丙认为,只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)的判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)的判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
13.下列溶液中各组离子一定能够大量共存的是( )
| A. | 含有Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| B. | 能使pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、CO32-、OH- | |
| D. | 能使淀粉KI试纸显蓝色的溶液:K+、SO42-、Fe2+、NH4+ |
11.下列说法正确的是( )
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
 .
.