题目内容
能正确表示CH4中碳原子成键方式的电子排布图为( )
A、 |
B、 |
C、 |
D、 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据杂化轨道理论,CH4中碳原子的价层电子对数为
=4,所以碳原子是sp3杂化,据此答题;
| 4+1×4 |
| 2 |
解答:
解:A、轨道没有杂化,还是基态原子的排布,故A错误;
B、杂化后的轨道能量应当相同,故B错误;
C、电子排布时应先排在能量低的轨道,故C错误;
D、CH4中碳原子的价层电子对数为
=4,所以碳原子是sp3杂化,即由一个s轨道和3个p轨道杂化后形成4个能量相同的轨道,根据洪特规则,每个轨道上有一个电子,故D正确;
故选D.
B、杂化后的轨道能量应当相同,故B错误;
C、电子排布时应先排在能量低的轨道,故C错误;
D、CH4中碳原子的价层电子对数为
| 4+1×4 |
| 2 |
故选D.
点评:本题主要考查了杂化轨道的电子排布图,难度不大,解题时要用好核外电子排布规律和杂化轨道理论.

练习册系列答案
相关题目
具有下列外围电子排布式的基态原子中,最容易形成离子的是( )
| A、3s23p1 |
| B、2s22p2 |
| C、3s2 |
| D、4s24p3 |
下列说法中正确的是( )
| A、所有的电子在同一区域里运动 |
| B、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
| C、电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| D、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
| A、C3H6和C4H6O2 |
| B、C2H4和C2H6O |
| C、C2H2和C6H6 |
| D、CH4O和C3H4O3 |
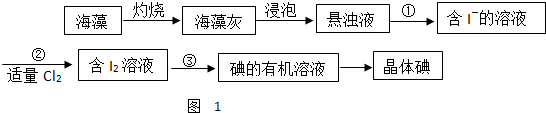
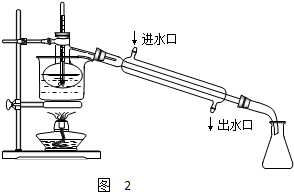
 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3辣反应生成CO2. 请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3辣反应生成CO2. 请回答下列问题: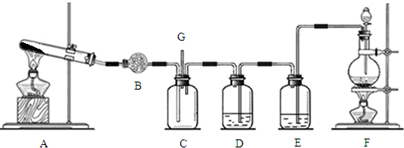
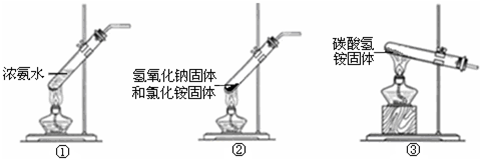
 电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答:
电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答: