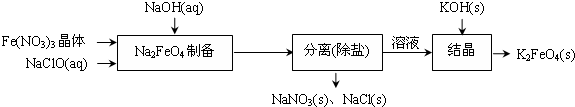
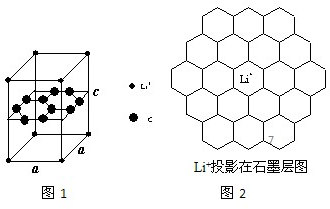
题目内容
现有540g质量分数为5%的CuCl2溶液.计算
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl-的物质的量.
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl-的物质的量.
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据m(溶质)=m(溶液)w(溶质)计算CuCl2的质量,再根据n=
计算CuCl2的物质的量;
(2)CuCl2完全电离:CuCl2=Cu2++2Cl-的,溶液中n(Cu2+)=n(CuCl2)、n(Cl-)=2n(CuCl2).
| m |
| M |
(2)CuCl2完全电离:CuCl2=Cu2++2Cl-的,溶液中n(Cu2+)=n(CuCl2)、n(Cl-)=2n(CuCl2).
解答:
解:(1)540g质量分数为5%的CuCl2溶液中m(CuCl2)=540g×5%=27g,则n(CuCl2)=
=0.2mol,
答:溶液中CuCl2的物质的量为0.2mol.
(2)溶液中n(Cu2+)=n(CuCl2)=0.2mol、n(Cl-)=2n(CuCl2)=0.2mol×2=0.4mol,
答:溶液中Cu2+的物质的量为0.2mol、Cl-的物质的量为0.4mol.
| 27g |
| 135g/mol |
答:溶液中CuCl2的物质的量为0.2mol.
(2)溶液中n(Cu2+)=n(CuCl2)=0.2mol、n(Cl-)=2n(CuCl2)=0.2mol×2=0.4mol,
答:溶液中Cu2+的物质的量为0.2mol、Cl-的物质的量为0.4mol.
点评:本题考查物质的量有关计算、质量分数有关计算,比较基础,注意对公式的理解,

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
常温下,pH相等的氨水和氢氧化钠溶液中的c(NH4+)和c(Na+)比较,则( )
| A、相等 | B、前者大 |
| C、后者大 | D、无法比较 |
下列化学式表示的物质中,含离子键并且含有极性共价键的是( )
| A、KCl |
| B、KOH |
| C、H2O |
| D、CaCl2 |
下列说法正确的是( )
| A、化合反应均为氧化还原反应,有单质生成的化学反应是氧化还原反应 |
| B、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C、溶液是电中性的,胶体是带电的 |
| D、电解质不一定导电,导电的物质不一定是电解质 |
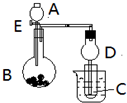 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: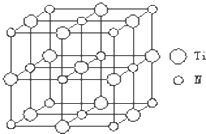 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.