题目内容
 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.(1)基态Ga原子的电子排布式可表示为
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为
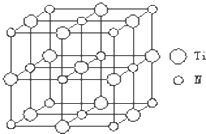
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有
④[Ti(OH)2(H2O)4]2+中的化学键有
a.σ键 b.π键 c.离子键 d.配位键.
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①根据价层电子对互斥理论确定其空间构型;
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式;
③钛的3d轨道上有未成对电子数为2个,位于第四周期,在同一周期中另外还有Ni的3d轨道上有8个电子即有2个未成对,Ge的4p轨道上有2个电子即有2个未成对,Se的4p轨道上有4个电子即有2个未成对,据此答题;
④根据[Ti(OH)2(H2O)4]2+中的成键特点可以判断;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①根据价层电子对互斥理论确定其空间构型;
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式;
③钛的3d轨道上有未成对电子数为2个,位于第四周期,在同一周期中另外还有Ni的3d轨道上有8个电子即有2个未成对,Ge的4p轨道上有2个电子即有2个未成对,Se的4p轨道上有4个电子即有2个未成对,据此答题;
④根据[Ti(OH)2(H2O)4]2+中的成键特点可以判断;
解答:
解:(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1,故答案为:[Ar]3d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;9NA;
(3)①N3-中价层电子对=2+
(5+1-2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线型,故答案为:直线型;
②该晶胞中C原子个数=8×
,N原子个数=6×
,Ti原子个数=1+12×
,所以其化学式为:Ti4CN3,故答案为:Ti4CN3;
③钛的3d轨道上有未成对电子数为2个,位于第四周期,在同一周期中另外还有Ni的3d轨道上有8个电子即有2个未成对,Ge的4p轨道上有2个电子即有2个未成对,Se的4p轨道上有4个电子即有2个未成对,故答案为:Ni、Ge、Se;
④根据[Ti(OH)2(H2O)4]2+中的成键特点可以看出,在这个配位离子中,水分子内部和氢氧根离子内部都是O-H单共价键,也就是σ键,水分子及氢氧根离子是配体,它们和而Ti2+之间是配位键,故答案为:ad;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;9NA;
(3)①N3-中价层电子对=2+
| 1 |
| 2 |
②该晶胞中C原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
③钛的3d轨道上有未成对电子数为2个,位于第四周期,在同一周期中另外还有Ni的3d轨道上有8个电子即有2个未成对,Ge的4p轨道上有2个电子即有2个未成对,Se的4p轨道上有4个电子即有2个未成对,故答案为:Ni、Ge、Se;
④根据[Ti(OH)2(H2O)4]2+中的成键特点可以看出,在这个配位离子中,水分子内部和氢氧根离子内部都是O-H单共价键,也就是σ键,水分子及氢氧根离子是配体,它们和而Ti2+之间是配位键,故答案为:ad;
点评:本题考查了核外电子排布、电负性、分子构型、晶胞的计算、配合物的结构等知识,中等难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、同温同压下,相同体积的物质,它们的物质的量必相等 |
| B、等体积、等物质的量浓度的强酸中所含的H+数目一定相等 |
| C、1 L一氧化碳气体的质量一定比1 L氧气的质量小 |
| D、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等 |
1000℃时,FeO(s)+H2?Fe(s)+H2O,K=0.52.欲使容器中有1.0mol FeO被还原,反应前容器中应充入a mol H2.则a最接近( )
| A、1.0 | B、2.0 |
| C、3.0 | D、4.0 |
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
 已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题: A、B、C、D、E为5种短周期元素,相对位置如图:
A、B、C、D、E为5种短周期元素,相对位置如图: