题目内容
按要求填空
(1)Ca周期表中位置 ;
(2)CO2电子式 ;
(3)Fe2+电子排布式 ;
(4)N电子排布图 .
(1)Ca周期表中位置
(2)CO2电子式
(3)Fe2+电子排布式
(4)N电子排布图
考点:电子式,原子核外电子的运动状态
专题:原子组成与结构专题
分析:(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
(3)铁原子失去最外层4s能级2个电子形成Fe2+,再根据核外电子排布规律进行书写;
(4)氮原子核外电子数为7,根据核外电子排布规律画出电子排布图.
(2)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
(3)铁原子失去最外层4s能级2个电子形成Fe2+,再根据核外电子排布规律进行书写;
(4)氮原子核外电子数为7,根据核外电子排布规律画出电子排布图.
解答:
解:(1)Ca原子核外电子排布式为1s22s22p63s23p64s2,处于周期表中第四周期ⅡA族,
故答案为:第四周期ⅡA族;
(2)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为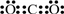 ,
,
故答案为: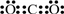 ;
;
(3)铁原子失去最外层4s能级2个电子形成Fe2+,其核外电子排布式为1s22s22p63s23p63d6,
故答案为:1s22s22p63s23p63d6;
(4)氮原子核外电子数为7,氮原子电子排布图为 ,
,
故答案为: .
.
故答案为:第四周期ⅡA族;
(2)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为
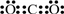 ,
,故答案为:
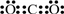 ;
;(3)铁原子失去最外层4s能级2个电子形成Fe2+,其核外电子排布式为1s22s22p63s23p63d6,
故答案为:1s22s22p63s23p63d6;
(4)氮原子核外电子数为7,氮原子电子排布图为
 ,
,故答案为:
 .
.
点评:本题考查结构与位置关系、常用化学用语等,难度中等,理解掌握核外电子排布规律是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法中,正确的是( )
| A、1.806×1024个O2的质量是64g |
| B、8g CH4的物质的量是0.5mol |
| C、18g H2O在标准状况下的体积约为22.4 L |
| D、将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L |
甲酸乙酯和乙酸丁酯的混合物中,碳元素的质量分数为58.5%,则氢元素质量分数为( )
| A、41.5% |
| B、31.75% |
| C、20.5% |
| D、9.75% |
下列各组互为同位素的是( )
A、
| ||||
| B、H2和D2 | ||||
| C、H2O和D2O | ||||
| D、O2和O3 |



 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.