题目内容
16.13C-NMR(核磁共振)可用于含碳化合物的结构分析.下列有关13C的说法不正确的是( )| A. | 13C的质量数是13,核外有6个电子 | |
| B. | 13C 与12C是两种不同的核素 | |
| C. | 13C 与12C互为同位素 | |
| D. | 13C 与12C 的化学性质有很大的差别 |
分析 根据原子符号ZAX的含义以及原子序数=质子数=核电荷数=核外电子数,中子数=质量数-质子数来解答.
A.电子数等于质子数;
B.具有一定数目的质子数、中子数的原子为核素;
C.质子数相同,中子数不同的原子为同位素;
D.元素的化学性质与原子最外层电子有关.
解答 解:A.13C的质量数是13,原子序数=质子数=核电荷数=核外电子数,所以核外有6个电子,故A正确;
B.136C与126C质子数均为6,中子数分别为7、6,均属碳元素的不同核素,故B正确;
C.126C与136C质子数均为6,中子数分别为6、7,均属碳元素的不同核素,互为同位素,故C正确;
D.13C 与12C 均属碳元素的不同核素,互为同位素,核外电子排布相同,化学性质几乎完全相同,故D错误;
故选D.
点评 本题主要考查了原子符号ZAX的含义以及原子序数=质子数=核电荷数=核外电子数,中子数=质量数-质子数,题目难度不大,注意同位素的化学性质几乎完全相同,为易错点.

练习册系列答案
相关题目
6.下列关于苯的叙述正确的是( )
| A. | 不能和氢气反应 | B. | 属于不饱和烃 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 含有碳碳双键 |
4.图中没有涉及到的能量转化形式是( )


| A. | 化学能转化为热能 | B. | 太阳能转化为化学能 | ||
| C. | 势能转化为电能 | D. | 化学能转化为势能 |
11.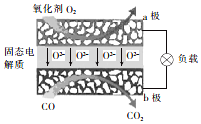 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )| A. | 电子从b极经导线流向a极 | |
| B. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 还可以选用NaOH固体作固态电解质 | |
| D. | 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2 |
1. X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W、Z对应的最高价氧化物对应的水化物的相对分子质量相等 |
8.“漆器”是中国古代在化学工艺及工艺美术方面的重要发明,所用生漆是从我国特产漆树割取的天然液汁.生漆主要成分是漆酚  ,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
 ,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
,-C15H27为链烃基,则漆酚不应具有的化学性质是( )| A. | 可以跟FeCl3溶液发生显色反应 | B. | 可以使酸性KMnO4溶液褪色 | ||
| C. | 可以跟Na2CO3溶液反应放出CO2 | D. | 可以发生取代反应和加成反应 |
5.表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为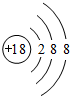 .
.
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是S>Cl>F(用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑤与元素⑧形成的化合物的电子式为 .
.
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是镁 (填名称),可以验证该结论的实验是BC(填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.(2)元素③、⑦、⑧中,原子半径从大到小的顺序是S>Cl>F(用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑤与元素⑧形成的化合物的电子式为
 .
.(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是镁 (填名称),可以验证该结论的实验是BC(填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
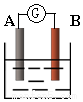 如图为原电池装置示意图:
如图为原电池装置示意图: