题目内容
20.在下列反应2KMnO4+16HCl(浓)=2KCl+MnCl2+5Cl2↑+8H2O中,氧化剂是KMnO4,还原剂是HCl氧化产物是Cl2,还原产物是MnCl2.每反应消耗1mol KMnO4时,转移的电子的数目为5NA,15.8g KMnO4能够与29.2g的HCl发生反应,若有73gHCl被氧化,可以生成标准状况下的氯气的体积为22.4L.分析 2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,则KMnO4为氧化剂,MnCl2为还原产物,Cl元素的化合价升高,失去电子被氧化,则HCl为还原剂,Cl2为氧化产物;
反应中Mn元素化合价由+7价降低为+2价,则每反应消耗1mol KMnO4时,转移的电子的数目为5NA,
n( KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,则可与0.8molHCl发生反应,M(HCl)=0.8mol×36.5g/mol=29.2g,
n(HCl)=$\frac{73g}{36.5g/mol}$=2mol,可生成1mol氯气,体积为22.4L.
故答案为:KMnO4;HCl;Cl2;MnCl2;5NA;29.2;22.4.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子计算的考查,题目难度不大.

练习册系列答案
相关题目
20.欲除去甲烷中混有的乙烯,得到纯净的甲烷,最好依次通过( )
| A. | 溴水,烧碱溶液,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 澄清石灰水,浓H2SO4 | D. | 浓H2SO4,酸性KMnO4溶液 |
1.下列物质的熔、沸点高低顺序正确的是( )
| A. | F2>Cl2>Br2>I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HF<HCl<HBr<HI | D. | CH4<SiH4<GeH4<SnH4 |
8.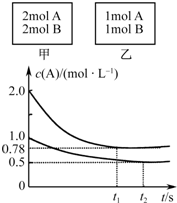 向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
 向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )| A. | 甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙) | |
| B. | x不可能等于2 | |
| C. | 将乙容器升温可使甲、乙容器内各物质的体积分数相同 | |
| D. | 若向甲容器中再充入2mol A、2mol B,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 |
15.现有部分短周期元素的性质或原子结构如表且原子序数按XYTZ依次增大:
(1)四种元素原子半径由大到小的顺序是(写元素符号)S>Cl>C>N.
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式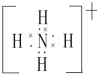 (用元素符号表示).
(用元素符号表示).
(3)T元素的简单阴离子的结构示意图是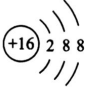 ,
,
(4)证明该粒子的还原性比Z-强的离子方程式是Cl2+S2-=S+2Cl-.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol•L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为68.5g.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式
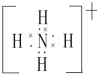 (用元素符号表示).
(用元素符号表示).(3)T元素的简单阴离子的结构示意图是
 ,
,(4)证明该粒子的还原性比Z-强的离子方程式是Cl2+S2-=S+2Cl-.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol•L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为68.5g.
12.下列说法正确的是( )
| A. | 0.1mol•L-1硫化钠溶液中离子浓度关系:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] | |
| B. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| C. | 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 0.1mol•L-1的氯化铵溶液与0.05mol•L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) |
9.下列实验中,只发生物理变化的是( )
| A. | 氨溶于水的喷泉实验 | |
| B. | 干冰暴露在干燥空气中,干冰周边气温降低 | |
| C. | 将分别蘸有浓氨水和浓盐酸的玻璃棒相互靠近,产生白烟 | |
| D. | 日光照射在装有新制氯水的烧瓶上,瓶中有气泡冒出 |
 .
.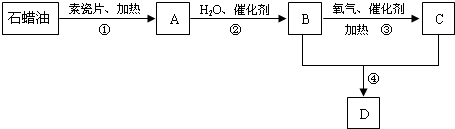
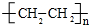 .
.