题目内容
11.在含NaCl、KCl、Na2SO4、K2SO4四种物质的混合液中,已知Na+、Cl- 和K+ 的物质的量浓度分别为0.80mol/L、0.70mol/L和0.40mol/L,则SO42- 的物质的量浓度为( )| A. | 0.25 mol/L | B. | 0.30 mol/L | C. | 0.40 mol/L | D. | 0.50 mol/L |
分析 任何电解质溶液中都存在电荷守恒,根据电荷守恒计算硫酸根离子浓度.
解答 解:任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(SO42-)=$\frac{c(N{a}^{+})+c({K}^{+})-c(C{l}^{-})}{2}$=$\frac{0.8+0.4-0.7}{2}$mol/L=0.25 mol/L,故选A.
点评 本题考查物质的量浓度有关计算,为高频考点,明确电解质溶液中存在的电荷守恒是解本题关键,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
1.下列描述中,不正确的是( )
| A. | 14N与15N具有相同的质子数 | B. | 18O和17O具有相同的电子数 | ||
| C. | 18O和19F具有相同的中子数 | D. | 12C与13C具有相同的质量数 |
2.下列混合物中括号内为杂质,要除杂所用的试剂和操作均正确的是( )
| A. | 乙烷(乙烯):酸性KMnO4溶液洗气 | B. | 乙醇(乙酸):生石灰蒸馏 | ||
| C. | 乙酸乙酯(乙醇):水分液 | D. | 溴苯(溴):CCl4溶液萃取分液 |
19.下列有关化学用语表示正确的是( )
| A. | H2O2的电子式: | B. | F的结构示意图: | ||
| C. | 中子数为20氯原子:2017Cl | D. | 次氯酸的结构式:H-O-Cl |
6.金属钠因保管不慎造成火灾,扑灭燃着的金属钠可用( )
| A. | 水 | B. | 泡沫灭火器 | C. | 黄沙 | D. | 煤油 |
3.下列物质能和NaHCO3溶液反应,既无气体逸出,也无沉淀生成的是( )
| A. | 石灰石 | B. | 熟石灰 | C. | 烧碱 | D. | 硫酸 |
20.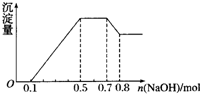 某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.2mol | |
| C. | 溶液中一定不含CO${\;}_{3}^{2-}$,可能含有SO${\;}_{4}^{2-}$和NO${\;}_{3}^{-}$ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |