题目内容
16.炭粉和氧化铜的混合物共a g,在隔绝空气的条件下加热一段时间并冷却,固体质量变为 b g,假设反应中炭粉全部转化为CO2,试计算:(1)被还原的氧化铜的质量;
(2)b的最小值.
分析 根据碳粉和氧化铜反应生成铜和二氧化碳,所以反应前后固体减少的质量就是二氧化碳的质量,利用方程式即可求出氧化铜的质量.
解答 解:根据碳粉和氧化铜反应生成铜和二氧化碳,所以反应前后固体减少的质量就是二氧化碳的质量,二氧化碳的质量=ag-bg=(a-b)g.
设原混合物中参加反应的氧化铜的质量是x.
2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
160 44
x (a-b)g
$\frac{160}{x}=\frac{44}{a-b}$
x=$\frac{40}{11}(a-b)g$,
a g炭粉和氧化铜的混合物的恰好完全反应,b值最小,所以b=$\frac{2×64}{160+12}×a$=$\frac{32}{43}a$g,
答:(1)原混合物中参加反应的氧化铜的质量是$\frac{40}{11}(a-b)g$;
(2)b的最小值为$\frac{32}{43}a$.
点评 此题是依据化学方程式计算的基础考查题,解题的关键是反应前后固体减少的质量就是二氧化碳的质量.

练习册系列答案
相关题目
6.某卡车在启动、刹车时排出大量浓烟,由此可以判断此卡车所用的燃料是( )
| A. | 酒精 | B. | 汽油 | C. | 柴油 | D. | 液化石油气 |
7.最近美国宇航局(NASA)找到了一种气体叫全氟丙烷(C3F8),它是比二氧化碳有效104倍的“超级温室气体”,并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: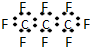 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
4.对于酒精灯火焰由外到里的分布正确的是( )
| A. | 外焰、内焰、焰心 | B. | 外焰、焰心、内焰 | C. | 内焰、焰心、外焰 | D. | 以上均不对 |
11.在含NaCl、KCl、Na2SO4、K2SO4四种物质的混合液中,已知Na+、Cl- 和K+ 的物质的量浓度分别为0.80mol/L、0.70mol/L和0.40mol/L,则SO42- 的物质的量浓度为( )
| A. | 0.25 mol/L | B. | 0.30 mol/L | C. | 0.40 mol/L | D. | 0.50 mol/L |
1.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4中含有氯原子数目为4 NA | |
| B. | 7 g C2H4中含有的氢原子数目为NA | |
| C. | 1 mol Al 失去电子变成 Al3+后质子数目为10 NA | |
| D. | 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5 NA |
8.现有300mL的某浓度的盐酸溶液,其中含溶质54.75g,现欲配制1mol/L的盐酸溶液,需原溶液和蒸馏水的体积比为(假设液体体积可以加和)( )
| A. | 1:4 | B. | 1:5 | C. | 2:1 | D. | 2:3 |
5.在下列化学反应中,符合既有离子键、共价键断裂,又有离子键、共价键形成的是( )
| A. | 2 Na2O2+2H2O═4NaOH+O2↑ | B. | 2 Na+2H2O═2NaOH+H2↑ | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$ 2H2O | D. | HCl+NH3═NH4Cl |
2.对于化学反应能否自发进行,下列说法中错误的是( )
| A. | 若△H>0,△S>0,低温时可自发进行 | |
| B. | 若△H<0,△S<0,低温时可自发进行 | |
| C. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| D. | 若△H>0,△S<0,任何温度下都不能自发进行 |