题目内容
3.常温下能用来盛放浓硝酸的金属器皿是( )| A. | Na | B. | Mg | C. | Al | D. | Cu |
分析 在常温下,金属铁和金属铝遇到浓硝酸会发生钝化,由此分析解答.
解答 解:在常温下,金属铁和金属铝遇到浓硝酸会发生钝化,可以用铁制或是铝制容器盛放浓硝酸,但是金属镁、铜和钠都可以和浓硝酸发生反应,常温下不可以用镁、铜和钠盛放浓硝酸,
故选C.
点评 本题考查学生金属和硝酸的反应情况知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
14.能使湿润的淀粉碘化钾试纸变蓝的有( )
| A. | CO2 | B. | H2S | C. | SO2 | D. | NO2 |
11.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为ls22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 | |
| C. | 2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 | |
| D. | 同一主族的X原子和Y原子 |
18.下列有关溶液中离子的检验方法正确的是( )
| A. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- | |
| B. | 向某溶液中先滴加硝酸再滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| C. | 向某溶液中滴加足量稀HCl,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32-或HCO3- | |
| D. | 向某盐溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则原溶液含NH4+ |
15.下表是元素周期表的一部分,请回答有关问题:
(1)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(2)④元素与⑦元素形成的化合物的电子式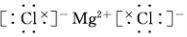 .
.
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填化学式)
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)④元素与⑦元素形成的化合物的电子式
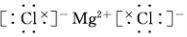 .
.(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填化学式)
12.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B 形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水为原料而获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
13.NO2被水吸收发生反应:3NO2+H2O=2HNO3+NO,该反应中发生还原反应的物质和发生氧化反应的物质的质量比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题. 实验室用无水酒精和浓硫酸(体积比1:3)的混合加热制乙烯气体.某学习小组设计了如图所示装置,用于制取乙烯并验证乙烯的性质.
实验室用无水酒精和浓硫酸(体积比1:3)的混合加热制乙烯气体.某学习小组设计了如图所示装置,用于制取乙烯并验证乙烯的性质.