题目内容
5.X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.X原子最外层电子数是次外层的3倍,X、M同主族,Y原子半径在同周期元素中最大,Z2+的电子层结构与氖原子相同,下列有关说法正确的是( )| A. | X与Y只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的酸性:N>M | |
| C. | 单质与水反应的剧烈程度:Z>Y | |
| D. | X和M的最高正价相同 |
分析 X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,已知X的最外层电子数是次外层电子数的3倍,则X是O元素;
X、M同主族,且M的原子序数大于X,所以M是S元素;
Y在同周期主族元素中原子半径最大,且原子序数大于X的短周期元素,则Y是Na元素;
Z2+的电子层结构与氖原子相同,所以Z是Mg元素;
N是原子序数大于M的短周期主族元素,所以N是Cl元素,以此解答该题.
解答 解:由以上分析可知X为O元素、Y为Na元素,Z为Mg元素,M为S元素,N为Cl元素.
A.X与Y可形成氧化钠、过氧化钠等化合物,故A错误;
B.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,即N>M,故B正确;
C.金属性Na>Mg,元素的金属性越强,对应的单质与水反应越剧烈,故C错误;
D.O无正价,故D错误.
故选B.
点评 本题考查原子结构及元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
16.下列8种有机物:①CH2═CH2 ②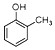 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
20.在120℃,1.01×105Pa时,将3L炔烃和烷的混合气体与相同状态下的14LO2混合,充分燃烧烃/后恢复到原来状态时.所得气体的体积是17L.则下列各组烃的混合物中可能是( )
| A. | C2H4和C2H6 | B. | C3H4和CH4 | C. | C2H2和CH4 | D. | C4H6和C2H6 |
7.下列有关物质的性质和应用均正确的是( )
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | Fe在O2中的燃烧产物可用于制红色涂料 | |
| C. | 瓷坩埚能耐高温,可用于加热熔化烧碱、纯碱等固体 | |
| D. | Mg (OH)2分解吸热且生成高熔点固体,可用作阻燃剂 |
8.下列溶液中c(Cl-)与50mL 1mol•L-1的AlCl3溶液中c(Cl-)相等的是( )
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 3 mol•L-1 KCl溶液 | D. | 75 mL 3 mol•L-1 FeCl3溶液 |