题目内容
10.根据反应8NH3+3Cl2→6NH4Cl+N2回答下列问题.(1)标出电子转移的方向和数目;
(2)氧化剂是Cl2,被氧化的元素是N.
(3)氧化剂与氧化产物的物质的量比213:28.
(4)当生成28gN2时,被氧化的物质的质量是34g.
分析 该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以NH3是还原剂、Cl2是氧化剂,再结合氮气和还原剂之间的关系式计算被氧化的物质的质量.
解答 解:(1)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为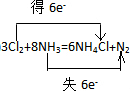 ,故答案为:
,故答案为: ;
;
(2)反应8NH3+3Cl2=6NH4Cl+N2中,N元素化合价升高,Cl元素的化合价降低,氧化剂是Cl2,被氧化的元素是N,故答案为:Cl2;N;
(3)该反应中氧化剂是氯气、氧化产物是氮气,其质量之比=(71×3):28=213:28,
故答案为:213:28;
(4)当生成28gN2时,氮气的物质的量=$\frac{28g}{28g/mol}$=1mol,根据氮原子守恒知,被氧化的氨气的物质的量是2mol,则被氧化的氨气的质量=2mol×17g/mol=34g,
故答案为:34.
点评 本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
20.下列实验操作或叙述正确的是(填序号)( )
| A. | 乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 | |
| B. | 将无水乙醇和浓硫酸按体积比3:1混合,加热至170℃制取乙烯 | |
| C. | 蔗糖水解用浓硫酸作催化剂 | |
| D. | 油脂皂化反应后,反应混合物中加入食盐可将肥皂分离出来 |
1.根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A. | 离子半径:S2->Cl->Ca2+ | B. | 还原性:I->Br->Cl- | ||
| C. | 热稳定性:HCl>H2S>H2Se | D. | 酸性:HClO4<HBrO4<HIO4 |
15.下列各组中两个化学反应,属于同一反应类型的一组是( )
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制溴苯;CH4制CH2Cl2 |
2.C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是( )
| A. | 2个甲基,能生成4种一氯代物 | B. | 4个甲基,能生成1种一氯代物 | ||
| C. | 3个甲基,能生成5种一氯代物 | D. | 4个甲基,能生成4种一氯代物 |
19.下列说法正确的是( )
| A. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| B. | 二氧化碳和CaCl2溶液反应,生成白色沉淀 | |
| C. | 二氧化硅和烧碱溶液反应,使溶液的碱性一定减弱 | |
| D. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 |
20.下列关于电解质溶液的叙述正确的是( )
| A. | 在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可以大量共存 | |
| B. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |