题目内容
反应C (s)+CO2(g)═2CO(g)在恒容容器、一定温度下达到平衡,再充入CO2,达到新的平衡时(温度不变),与原平衡比,以下正确的是( )
| A、平衡向正反应方向移动 |
| B、混合气体的平均摩尔质量增大 |
| C、CO2的转化率增大 |
| D、正反应速率增大逆反应速率减小 |
考点:化学平衡的影响因素
专题:
分析:反应C (s)+CO2(g)?2CO(g)在恒容容器、一定温度下达到平衡,由于C为固体,再充入CO2,相当于在另一个完全相同的容器中反应,二者达到的平衡为等效平衡,再推压到原来的容器里,由于压强增大,平衡向逆反应方向移动,使CO2的转化率减小,依此解答.
解答:
解:反应C (s)+CO2(g)?2CO(g)在恒容容器、一定温度下达到平衡,由于C为固体,再充入CO2,相当于在另一个完全相同的容器中反应,二者达到的平衡为等效平衡,再推压到原来的容器里,由于压强增大,平衡向逆反应方向移动,使CO2的转化率减小,
A、平衡向逆反应方向移动,故A错误;
B、CO2的摩尔质量大于CO的摩尔质量,CO2的量增加,平均摩尔质量增大,故B正确;
C、平衡向逆反应方向移动,CO2的转化率减小,故C错误;
D、充入CO2,浓度增大,正逆反应速率都增大,但是逆反应速率大于正反应速率,故D错误.
故选:B.
A、平衡向逆反应方向移动,故A错误;
B、CO2的摩尔质量大于CO的摩尔质量,CO2的量增加,平均摩尔质量增大,故B正确;
C、平衡向逆反应方向移动,CO2的转化率减小,故C错误;
D、充入CO2,浓度增大,正逆反应速率都增大,但是逆反应速率大于正反应速率,故D错误.
故选:B.
点评:本题考查了浓度和压强对化学平衡的影响,注意由于C为固体,再充入CO2,再次达到平衡和原平衡时等效平衡,所以平衡逆向移动是易错点.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
下列关于硫化氢或氢硫酸的描述,正确的是( )
| A、氢硫酸因含-2价的硫,所以只有还原性 |
| B、硫化氢气体通入硫酸亚铁中有黑色沉淀生成 |
| C、实验室制取硫酸氢时,可以用稀盐酸或稀硫酸,但不能用浓硫酸或硝酸 |
| D、氢硫酸溶液中加入镁粉会有氢气产生 |
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
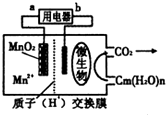

| A、电池工作时,电子由a流向b |
| B、微生物所在电极区放电时发生还原反应 |
| C、放电过程中,H+从正极区移向负极区 |
| D、正极反应式为:MnO2+4H++2e-═Mn2++2 H2O |
 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )| A、烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
| B、产物在a中第一层 |
| C、a中有产物和水还含HBr、CH3CH2OH等 |
| D、b中盛放的酸性KMnO4溶液会褪色 |
甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下.下列说法正确的是( )

| A、该装置为电能转化为化学能的装置 |
| B、a电极发生的电极反应为CH3OH-6e-+H2O═CO2↑+6H+ |
| C、当电路中有1 mol e-转移时,正极区n(H+)增加1 mol |
| D、将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流 |
化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、煤经过分馏和干馏两个物理变化,可变为清洁能源 |
| C、电镀厂的废水直接用来灌溉农田,可提高水的利用率 |
| D、用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染 |
 .现用如图装置制备环己酮(部分夹持仪器未画出):
.现用如图装置制备环己酮(部分夹持仪器未画出):
