题目内容
下列关于硫化氢或氢硫酸的描述,正确的是( )
| A、氢硫酸因含-2价的硫,所以只有还原性 |
| B、硫化氢气体通入硫酸亚铁中有黑色沉淀生成 |
| C、实验室制取硫酸氢时,可以用稀盐酸或稀硫酸,但不能用浓硫酸或硝酸 |
| D、氢硫酸溶液中加入镁粉会有氢气产生 |
考点:硫化氢
专题:元素及其化合物
分析:A、氢硫酸因含-2价的硫,所以有还原性,氢元素是+1价,所以也具有弱氧化性;
B、硫酸亚铁溶液中通入硫化氢气体不发生反应,FeS可溶于硫酸;
C、强酸制弱酸,硫化氢具有还原性,而浓硫酸或硝酸具有强氧化性;
D、Mg+H2S(水溶液)═MgS+H2↑.
B、硫酸亚铁溶液中通入硫化氢气体不发生反应,FeS可溶于硫酸;
C、强酸制弱酸,硫化氢具有还原性,而浓硫酸或硝酸具有强氧化性;
D、Mg+H2S(水溶液)═MgS+H2↑.
解答:
解:A、氢硫酸因含-2价的硫,所以有还原性,氢元素是+1价,所以也具有弱氧化性,所以不是只有还原性,故A错误;
B、硫酸亚铁溶液中通入硫化氢气体不发生反应,FeS可溶于硫酸,无沉淀产生,故B错误;
C、强酸制弱酸,硫化氢具有还原性,而浓硫酸或硝酸具有强氧化性,所以实验室制取硫酸氢时,可以用稀盐酸或稀硫酸,但不用浓硫酸或硝酸,故C正确;
D、Mg+H2S(水溶液)═MgS+H2↑,即氢硫酸溶液中加入镁粉会有氢气产生,故D正确;
故选CD.
B、硫酸亚铁溶液中通入硫化氢气体不发生反应,FeS可溶于硫酸,无沉淀产生,故B错误;
C、强酸制弱酸,硫化氢具有还原性,而浓硫酸或硝酸具有强氧化性,所以实验室制取硫酸氢时,可以用稀盐酸或稀硫酸,但不用浓硫酸或硝酸,故C正确;
D、Mg+H2S(水溶液)═MgS+H2↑,即氢硫酸溶液中加入镁粉会有氢气产生,故D正确;
故选CD.
点评:本题考查硫化氢及水溶液的性质,学生要学会通过化合价分析氧化性和还原性,以及气体的制备,综合性较强,比较容易.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
有甲酸、乙酸和乙二酸组成的混合物a g,经完全燃烧可生成CO20.2mol;完全中和等质量的该混合物消耗80mL 2mol/L的NaOH溶液,则a值可能为( )
| A、8.00 | B、7.92 |
| C、7.90 | D、7.86 |
下列叙述正确的是( )
| A、用锡焊接的铁质器件,焊接处易生锈 |
| B、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
| C、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| D、将钝化后的铝条放入CuSO4溶液中无现象,说明铝的金属性弱于铜 |
用表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、16.9 g过氧化钡(BaO2)加入足量H2O中转移电子数目为0.1NA |
| B、常温常压下,28 g乙烯含有的电子数为16NA |
| C、标准状况下,ag某气体舍分子数为b,则cg该气体的体积为bc/a L |
| D、1 mol丙烷分子中含有的共用电子对数为8NA |
反应C (s)+CO2(g)═2CO(g)在恒容容器、一定温度下达到平衡,再充入CO2,达到新的平衡时(温度不变),与原平衡比,以下正确的是( )
| A、平衡向正反应方向移动 |
| B、混合气体的平均摩尔质量增大 |
| C、CO2的转化率增大 |
| D、正反应速率增大逆反应速率减小 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A、常温下,78g的苯含有3NA个 双键 双键 |
| B、1L 0.1 mol?L-1的NH4Cl溶液中有0.1NA个NH4+ |
| C、标准状况下,22.4 L SO2与CO2混合物含有2NA个O原子 |
| D、常温下,5.6 g铁块投入足量浓硝酸中失去0.3NA个电子 |

 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.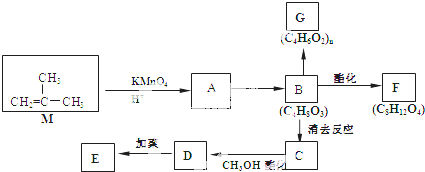
 ⑦CH3-CH2-CH2-O-CH3⑧CH2═CH-CH2-CH2-CH3
⑦CH3-CH2-CH2-O-CH3⑧CH2═CH-CH2-CH2-CH3