题目内容
2. (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1②2CO(g)+O2(g)=2CO2(g)△H=b kJ•mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=c kJ•mol-1;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=c+2a-bkJ•mol-1.(用含a、b、c的式子表示)
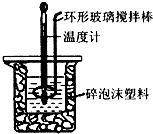
(2)用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| 平均值 | |||||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
②装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
③某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
④计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
⑤若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
分析 (1)结合盖斯定律可知,③+①×2-②得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),以此来解答;
(2)①依据量取溶液的体积选择合适的量筒;
②中和热测定实验成败的关键是减少热量的损失;
③中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
④先判断数据的有效性,然后计算出平均温度差,再根据Q=m•c•△T计算反应放出的热量;
⑤根据弱电解质电离吸热分析.
解答 解:(1)由①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=b kJ•mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=c kJ•mol-1;
结合盖斯定律可知,③+①×2-②得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=(c+2a-b)kJ•mol-1;
故答案为:c+2a-b;
(2)①在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是50ml量筒和胶头滴管;
故答案为:50ml量筒;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
③中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
故答案为:混合溶液的最高;
④第三次得到温度差误差较大,应该舍弃,所以平均温度差为:$\frac{3.25℃+3.15℃}{2}$=3.2℃,溶液的质量为100ml×1g/ml=100g,则该反应中放出的热量为:Q=m•c•△T=100g×4.2J/(g•℃)×3.2℃=1344J;
故答案为:1344;
⑤一水合氨为弱碱,电离过程为吸热过程,放出的热量偏少,但中和热△H为负值,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热偏大;
故答案为:偏大;一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大;
点评 本题考查了盖斯定律计算反应热,中和热的测定,明确中和热的测定步骤为解答关键,注意掌握中和热计算方法,试题培养了学生的分析能力及化学实验能力,难度中等.


| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定不含有FeCl2,含有少量AlCl3 | |
| C. | 混合物中含有0.05molMgCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Y元素在周期表中的位置为第二周期第ⅤIA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实不能说明Z 元素的非金属性比S 元素的非金属性强的是:b
a.Z的单质与H2S溶液反应,溶液变浑浊
b.Z的含氧酸HZO3酸性比H2SO4强
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
d.化合物SZ2中S显正价,Z显负价
(4)表中某元素的最高价含氧酸与其气态氢化物反应生成一种盐,该盐所含化学键的类型为离子键、共价键.
(5)碳、Y和硫三种元素按1:l:l个数比形成化合物,每个原子都达到8电子的稳定结构,该化合物的电子式为
 .
.(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成两种有毒气体,均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和lmolO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| A. | 氢氧化钡溶液与过量稀硫酸反应:Ba2++OH-+SO42-+H+=H2O+BaSO4↓ | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 氯化镁溶液与过量的氨水反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 稀硫酸与过量的铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
| A. | 次氯酸钙 | B. | 液氯 | C. | 氯水 | D. | 胆矾 |
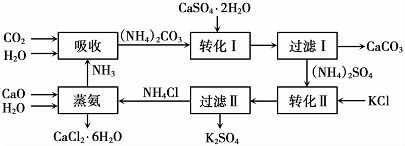
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式CaSO4+CO32-=CaCO3+SO42-
(3)过滤I操作所得固体中,除CaC03外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-
(5)已知不同温度下K2SO4在l00g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad.
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |
(2)B中干燥管中应选用的药品为c(填字母)
a.无水 CuSO4 b.硅胶 c.碱石灰
(3)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H=-456kJ•mol-1
已知:

①NH3的电子式是
 .
.②断开1mol H-N键与断开1mol H-Cl键所需能量相差约为40KJkJ.
(4)现象ⅱ中产生白烟的化学方程式是HCl+NH3=NH4Cl
(5)某学生设计了如图装置以完成Cl2和NH3的反应.若该装置能实现设计目标,则

①石墨b电极上发生的是还原反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式:2NH3+6OH--6e-=N2+6H2O.
| A. |  2-甲基-3-丁烯 2-甲基-3-丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | C. |  2-乙基丙烷 2-乙基丙烷 | D. |  2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |