题目内容
7.下列物质中,属于混和物的是( )| A. | 次氯酸钙 | B. | 液氯 | C. | 氯水 | D. | 胆矾 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分逐项分析即可.
解答 解:A.次氯酸钙是一种物质组成的化合物为纯净物,故A错误;
B.液氨是液态氨气是一种物质组成的纯净物,故B错误;
C.氯水是氯气的水溶液属于混合物,故C正确;
D.胆矾是硫酸铜晶体是一种物质组成的纯净物,故D错误;
故选C.
点评 本题考查了物质分类、物质组成和物质名称,解答本题要充分理解纯净物和混合物的区别,要分析物质是由几种物质组成的,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物,题目难度不大.

练习册系列答案
相关题目
3.反应4A(s)+3B(g)?2C(g)+D(g),经2min后,B的浓度减少了0.6mol•L-1.对此反应速率的叙述正确的是( )
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 在2 min末时的反应速率,用反应物B来表示是0.3 mol•L-1•min-1 | |
| D. | 在这2 min内用B和C表示的反应速率的值都是相同的 |
4.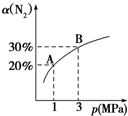 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 平衡状态由A变到B时,平衡常数K(A)=K(B) | |
| B. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| C. | 升高温度,逆反应速率增大,正反应速率减小 | |
| D. | 上述反应达到平衡后,增大H2浓度,平衡正向移动,H2转化率增大 |
2. (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=b kJ•mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=c kJ•mol-1;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=c+2a-bkJ•mol-1.(用含a、b、c的式子表示)
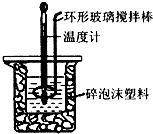
(2)用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
①该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要50ml量筒;
②装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
③某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
④计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
⑤若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
 (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1②2CO(g)+O2(g)=2CO2(g)△H=b kJ•mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=c kJ•mol-1;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=c+2a-bkJ•mol-1.(用含a、b、c的式子表示)
(2)用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| 平均值 | |||||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
②装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
③某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
④计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
⑤若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
12.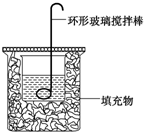 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
(1)该装置中缺少的一种玻璃仪器是温度计;烧杯间填充物的作用是保温隔热,减少热量损失.
(2)实验时环形玻璃搅拌棒的运动方向是a.
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(3)实验中,所用NaOH溶液稍过量的原因是保证盐酸能够完全被中和;如果用0.50mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将偏大(填“偏大”“偏小”或“不变”).
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
已知盐酸、NaOH溶液密度均近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热△H=-56.8kJ/mol.(保留到小数点后1位)
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式的温度差平均值为2.35℃.
 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.(1)该装置中缺少的一种玻璃仪器是温度计;烧杯间填充物的作用是保温隔热,减少热量损失.
(2)实验时环形玻璃搅拌棒的运动方向是a.
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(3)实验中,所用NaOH溶液稍过量的原因是保证盐酸能够完全被中和;如果用0.50mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将偏大(填“偏大”“偏小”或“不变”).
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式的温度差平均值为2.35℃.
19.下列反应不能通过一步反应实现的是( )
| A. | SiO2→H2SiO3 | B. | Cu→CuSO4 | C. | Fe→FeCl2 | D. | Al→Na[Al(OH)4] |
17.在pH=1的澄清透明溶液中,不能大量共存的离子组是( )
| A. | Na+、K+、NO3-、CO32- | B. | Cu2+、NH4+、SO42-、Cl- | ||
| C. | Ba2+、K+、Cl-、Br- | D. | Zn2+、Na+、NO3-、SO42- |