题目内容
14.跟12.8gSO2所含原子数相等的NO的质量为( )| A. | 3.0g | B. | 6.0g | C. | 9.0g | D. | 18.0g |
分析 根据n=$\frac{m}{M}$计算出二氧化硫的物质的量,然后可计算出该二氧化硫中含有的原子数,再结合NO的分子组成计算出一氧化氮的物质的量,最后根据m=nM计算出需要NO的质量.
解答 解:12.8gSO2的物质的量为:$\frac{12.8g}{64g/mol}$=0.2mol,0.2mol SO2中含有原子的物质的量为:0.2mol×3=0.6mol,
含有0.6mol原子需要NO的物质的量为:$\frac{0.6mol}{2}$=0.3mol,需要NO的物质的量为:30g/mol×0.3mol=9.0g,
故选C.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
相关题目
19.能证明NaCl是离子化合物的事实是( )
| A. | 常温下是固体 | B. | 易溶于水 | C. | 水溶液能导电 | D. | 熔融态能导电 |
9.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为NA | |
| B. | 标准状况下,22.4L水中含有的分子数为NA | |
| C. | 92g NO2和N2O4混合气体中含有的原子数为6NA | |
| D. | 1.7g H2O2中含有的电子数为0.9NA |
6.X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其电子数的$\frac{2}{3}$,Y和W是同一周期中原子半径相差最大两种元素.下列叙述正确的是( )
| A. | 原子半径:W>Z | |
| B. | X、Y 均能与W形成的离子化合物 | |
| C. | Z、W的气态氢化物的稳定性:Z>W | |
| D. | X、Z的最高价氧化物的水化物酸性:X>Z |


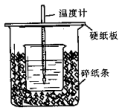 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: