题目内容
现有CO、H2、和CO2组成的混合气体116.8L(标准状况),经完全燃烧后放出的总能量为867.9KJ,并生成18g液态水.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol; 2CO(g)+O2(g)═2CO2(g);△H=-566KJ/mol.则燃烧以前混合气体中CO的体积分数最接近于( )
| A、80% | B、60% |
| C、40% | D、20% |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据18g水,计算氢气燃烧放出的热量;根据总能量为867.9KJ和氢气燃烧放出的热量计算CO的物质的量,依此计算出CO的体积分数.
解答:
解:2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol; 2CO(g)+O2(g)═2CO2(g);△H=-566KJ/mol.生成的H2O是18g,是1mol,故氢气燃烧放出的热量为:
=285.8kJ,而总热量是867.9KJ,故CO燃烧放出来的热量为:867.9-285.8=582.1kJ,故CO的物质的量是:
×2mol=2.06mol,混合气体的总物质的量为:
=5.21mol,故混合前CO的体积分数为:
×100%=39.5%,接近于40%,
故选C.
| 571.6 |
| 2 |
| 582.1 |
| 566 |
| 116.8 |
| 22.4 |
| 2.06 |
| 5.21 |
故选C.
点评:本题考查反应热的相关计算,难度中等.

练习册系列答案
相关题目
 某可逆反应:mA(g)+nB(g)?pC(g);在密闭容器中进行,如图所示,反应在不同时间t、温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
某可逆反应:mA(g)+nB(g)?pC(g);在密闭容器中进行,如图所示,反应在不同时间t、温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )| A、T1<T2,p1>p2,n+m>p,(正反应为吸热反应) |
| B、T1>T2,p1>p2,n+m>p,(正反应为吸热反应) |
| C、T1>T2,p1>p2,n+m<p,(正反应为吸热反应) |
| D、T1>T2,p1>p2,n+m>p,(正反应为放热反应) |
下列各组物质的溶液,两者相互滴加现象不同的是( )
| A、FeCl3和NaOH |
| B、NaHCO3和HCl |
| C、NaAlO2和HCl |
| D、AlCl3和NH3?H2O |
某同学在做苯酚的性质实验时,将少量溴水滴入苯酚溶液中,结果没有发生沉淀现象,他思考了一下,又继续进行了如下操作,结果发现了白色沉淀,你认为该同学进行了下列哪项操作( )
| A、又向溶液中滴入了足量的氢氧化钠溶液 |
| B、又向溶液中滴入了乙醇 |
| C、又向溶液中滴入了过量的苯酚溶液 |
| D、又向溶液中滴入了过量的浓溴水 |
下列说法正确的是( )
| A、能通过化合反应制得FeCl2和Fe(OH)3 |
| B、7.8g Na2O2与CO2完全反应,转移0.2mol电子 |
| C、2.7g Al与足量的氢氧化钠溶液完全反应,生成3.36L气体 |
| D、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
下列反应中Fe3+离子表现氧化性的是( )
| A、FeCl3溶液能使KI淀粉试纸变蓝 |
| B、FeCl3溶液滴入沸水中产生红褐色的胶体 |
| C、FeCl3溶液中加入AgNO3溶液产生白色沉淀 |
| D、FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
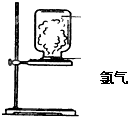 如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题: