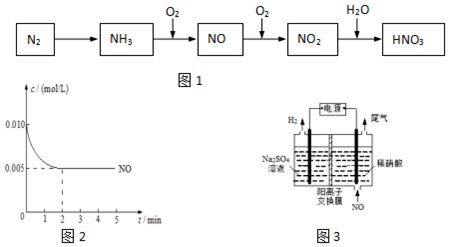
题目内容
8.25℃、101kPa下充分燃烧一定量丁烷(C4H10)气体放出的热量为Q kJ,用5mol/L的KOH溶液200mL完全吸收生成的CO2,并与之生成正盐,则丁烷的燃烧热的数值是( )| A. | 16Q | B. | 8Q | C. | 4Q | D. | 2Q |
分析 燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据CO2与KOH的反应,计算出CO2的物质的量,进而计算出丁烷的物质的量,则可计算丁烷的燃烧热.
解答 解:n(KOH)=0.2L×5mol/L=1mol,则由CO2~2KOH可知,n(CO2)=0.5mol,
则n(C4H10)=$\frac{1}{4}$×n(CO2)=$\frac{1}{4}$×0.5mol=$\frac{1}{8}$mol,放出的热量为QkJ,
所以1mol丁烷完全燃烧放出的热量为8QkJ,
故选B.
点评 本题考查燃烧热的计算,题目难度不大,本题注意把握燃烧热的概念,根据生成二氧化碳的物质的量计算丁烷的物质的量是解答该题的关键.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
19.下列溶液肯定显酸性的是( )
| A. | 和金属铝反应产生氢气的溶液 | B. | 加酚酞显无色的溶液 | ||
| C. | pH<7的溶液 | D. | c(H+)>c(OH-)的溶液 |
16.NA表示阿伏加罗常数的值,下列说法正确的是( )
| A. | 2.2g CO2中含有的分子数为0.1NA | |
| B. | 0.5mol Na2CO3固体中含有的Na+数为0.5NA | |
| C. | Na2O2与足量水反应时,生成1molO2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的碳原子数为0.2NA |
3.向FeSO4溶液中加入Na2O2至过量,溶液中数目基本不变的离子是( )
| A. | Fe2+ | B. | SO42- | C. | Na+ | D. | OH- |
13.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3.下列叙述不正确的是( )
| A. | HA是一种弱酸 | |
| B. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) | |
| C. | 体积、浓度均相等的HA溶液与盐酸溶液分别与足量锌反应,产生氢气质量相同 | |
| D. | 该HA溶液中:2c(H+)=c(OH-)+c(A-)+c(HA) |
4.下列说法正确的是( )
| A. | 乳酸薄荷醇酯( 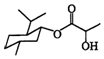 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛( 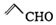 )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示二者均有三种不同的氢原子且三种氢原子数的比例相同,故不能用1H-NMR来鉴别 |
1.中科大教授联合美国科学家发现雾霾形成与硫酸氢铵有关,NH4HSO4属于( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |