题目内容
13.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3.下列叙述不正确的是( )| A. | HA是一种弱酸 | |
| B. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) | |
| C. | 体积、浓度均相等的HA溶液与盐酸溶液分别与足量锌反应,产生氢气质量相同 | |
| D. | 该HA溶液中:2c(H+)=c(OH-)+c(A-)+c(HA) |
分析 A.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3,说明酸部分电离;
B.根据电荷守恒可知:c(A-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得:c(A-)+c(HA)=2c(Na+)计算分析;
C.体积、浓度均相等的HA溶液与盐酸溶液中溶质物质的量相同,分别与足量锌反应,产生氢气质量相同;
D.酸溶液中存在电荷守恒和溶质为弱电解质存在电离平衡分析.
解答 解:A.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3,说明酸部分电离,酸HA为弱酸,故A正确;
B.0.1mol•L-1的HA溶液与0.05mol•L-1的NaOH溶液等体积混合,溶质为等浓度的HA和NaA,根据电荷守恒可知:c(A-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得:c(A-)+c(HA)=2c(Na+),二者结合得到:2c(H+)+c(HA)=c(A-)+2c(OH-),故B正确;
C.体积、浓度均相等的HA溶液与盐酸溶液中溶质物质的量相同,分别与足量锌反应,生成氢气相同,故C正确;
D.c(H+)=c(OH-)+c(A-),c(HA)>c(H+),则2c(H+)<c(OH-)+c(A-)+c(HA),故D错误;
故选D.
点评 本题考查了弱电解质电离平衡、电解质溶液中电荷守恒,主要是微粒的定量关系,掌握基础是解题关键,题目难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
3.硅是带来人类文明的重要元素之一.下列物质中主要成分是硅酸盐的是( )
| A. | 青花瓷 | B. | 金刚石 | C. | 光导纤维 | D. | 大理石 |
1.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 证明溶液中一定含有SO32- | 将该溶液与稀盐酸反应产生的气体通入澄清石灰水,有白色沉淀生成 |
| B | 证明氯气中混有氯化氢气体 | 将该混合气体通入AgNO3溶液中,有白色沉淀生成 |
| C | 证明某固体中有Na+,无K+ | 灼烧该固体,火焰呈黄色 |
| D | 证明Br-还原性强于Cl- | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 |
| A. | A | B. | B | C. | C | D. | D |
8.25℃、101kPa下充分燃烧一定量丁烷(C4H10)气体放出的热量为Q kJ,用5mol/L的KOH溶液200mL完全吸收生成的CO2,并与之生成正盐,则丁烷的燃烧热的数值是( )
| A. | 16Q | B. | 8Q | C. | 4Q | D. | 2Q |
2.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LH2O含有分子数为1NA | |
| B. | 常温常压下,224LH2和O2的混合气体所含分子数为NA | |
| C. | 通常状况下,1molCl2与足量Na反应转移电子数为NA | |
| D. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
9.PASNa(二水合对氨基水杨酸钠)是抗结核药,其结构简式如图化合物1所示,下列说法正确的是( )


| A. | 化合物1和化合物2均能使酸性KMnO4溶液褪色 | |
| B. | 化合物1的核磁共振氢谱测出5个谱峰 | |
| C. | PASNa与足量盐酸反应生成如上图化合物2 | |
| D. | 通入足量CO2能将图化合物3转化为PASNa |
6.在含有较多NH4+、Ba2+、NO3- C1-的溶液中还能大量共存的离子是( )
| A. | Ag+ | B. | Mg2+ | C. | S042- | D. | OH- |
7.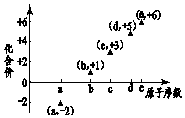 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d互为同素异形体 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |