题目内容
7.一定条件下,在容积为5L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),半分钟后测得生成0.04molSO3.在这段时间内O2的化学反应速率为( )| A. | 0.004(mol•L-1•min-1) | B. | 0.008(mol•L-1•min-1) | ||
| C. | 0.016(mol•L-1•min-1) | D. | 0.032(mol•L-1•min-1) |
分析 根据v=$\frac{\frac{△n}{V}}{△t}$计算v(SO3),再利用速率之比等于化学计量数之比计算v(O2).
解答 解:半分钟后测得生成0.04mol SO3,则v(SO3)=$\frac{\frac{0.04mol}{5L}}{0.5min}$=0.016mol/(L.min),
速率之比等于化学计量数之比,故v(O2)=$\frac{1}{2}$v(SO3)=$\frac{1}{2}$×0.016mol/(L.min)=0.008mol/(L.min),
故选B.
点评 本题考查化学反应速率的计算,比较基础,注意常用计算方法有公式法与化学计量数法,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
17.20世纪80年代后期人们逐渐认识到,NO是血压调节的主要因子,在心血管系统中起着重要的作用.下列关于NO的说法中,错误的是( )
| A. | NO是无色气体 | B. | NO是汽车尾气的有害成分之一 | ||
| C. | 可以用向上排空气法收集NO | D. | NO在一定条件下也可做氧化剂 |
18.下列电离方程式或离子方程式书写正确的是( )
| A. | HF在水溶液中的电离方程式:HF=H++F- | |
| B. | 醋酸与氢氧化钠反应的离子方程式:H++OHˉ?H2O | |
| C. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32ˉ | |
| D. | CuSO4在水溶液中水解的离子方程式:Cu2++2H2O?Cu (OH)2+2H+ |
15. Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法错误的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法错误的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法错误的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法错误的是( )| A. | 溶液中Cl-向石墨电极移动 | |
| B. | H2O2在石墨电极上发生的电极反应是:H2O2+2e-═2OH- | |
| C. | Mg电极发生氧化反应 | |
| D. | 电子从Mg电极沿导线流向石墨电极 |
12.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
19.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
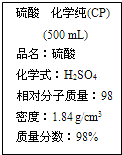

| A. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L | |
| B. | 1 mol Mg与足量该硫酸反应产生2 g氢气 | |
| C. | 配制250 mL 1.0 mol/L的稀硫酸需取该硫酸约13.6mL | |
| D. | 该硫酸溶液可作H2S的干燥剂 |
17.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| B. | 0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| C. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| D. | 1L0.1mol•L-1Na2CO3溶液中含有的阴离子数为0.1NA |



