题目内容
(1)实验室用水解法制备氢氧化铁胶体,将饱和三氯化铁溶液滴入沸水加热到溶液呈红褐色,请写出反应的化学方程式 .
(2)Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,溶于足量水并充分反应后,溶液中Ca2+、CO32-、HCO3- 全部转化为沉淀,将反应容器内水分蒸干,最后得到白色固体29.0g,原混合物中Na2CO3的质量是 g.
(2)Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,溶于足量水并充分反应后,溶液中Ca2+、CO32-、HCO3- 全部转化为沉淀,将反应容器内水分蒸干,最后得到白色固体29.0g,原混合物中Na2CO3的质量是
考点:有关混合物反应的计算,胶体的重要性质
专题:计算题,溶液和胶体专题
分析:(1)将饱和三氯化铁溶液滴人沸水中可以制取氢氧化铁胶体,据此写出反应的化学方程式;
(2)将反应容器内水分蒸干,最后得到白色固体质量增加,根据反应方程式可知,固体增加的质量为参加反应的水的质量,然后根据反应方程式计算出混合物中碳酸钠的质量.
(2)将反应容器内水分蒸干,最后得到白色固体质量增加,根据反应方程式可知,固体增加的质量为参加反应的水的质量,然后根据反应方程式计算出混合物中碳酸钠的质量.
解答:
解:(1)实验室制备氢氧化铁胶体的方法是:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,要注意实验过程不能用玻璃棒搅拌,否则溶液出现浑浊;当反应体系呈现红褐色,即制得氢氧化铁胶体,应立即停止加热,否则也容易出现浑浊,产生红褐色的氢氧化铁沉淀,往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜长时间加热,反应的化学方程式为为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl;
(2)设原混合物中Na2CO3的质量为x,发生的反应方程式有:①CaO+H2O=Ca(OH)2、②NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、③Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
①+②得④:CaO+NaHCO3=CaCO3↓+NaOH,
①+③得⑤:CaO+H2O+Na2CO3=CaCO3↓+2NaOH,
反应④中CaO与NaHCO3反应不会引起固体质量增加,
反应⑤即CaO与Na2CO3反应,由于H2O参加反应,会引起固体质量增加,
即:固体增加的质量等于参加反应的水的质量,
因此根据反应⑤:H2O+CaO+Na2CO3 =CaCO3↓+2NaOH
18 106
29.0g-27.2g=1.8g m(Na2CO3)
则:m(Na2CO3)=
=10.6g,
故答案为:10.6.
| ||
故答案为:FeCl3+3H2O
| ||
(2)设原混合物中Na2CO3的质量为x,发生的反应方程式有:①CaO+H2O=Ca(OH)2、②NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、③Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
①+②得④:CaO+NaHCO3=CaCO3↓+NaOH,
①+③得⑤:CaO+H2O+Na2CO3=CaCO3↓+2NaOH,
反应④中CaO与NaHCO3反应不会引起固体质量增加,
反应⑤即CaO与Na2CO3反应,由于H2O参加反应,会引起固体质量增加,
即:固体增加的质量等于参加反应的水的质量,
因此根据反应⑤:H2O+CaO+Na2CO3 =CaCO3↓+2NaOH
18 106
29.0g-27.2g=1.8g m(Na2CO3)
则:m(Na2CO3)=
| 1.8g×106 |
| 18 |
故答案为:10.6.
点评:本题考查有关混合物反应的计算、化学方程式的书写,题目难度中等,注意掌握化学方程式的书写原则,明确物质之间的反应原理,正确分析固体质量变化的原因为解答本题的关键.

练习册系列答案
相关题目
往AlCl3溶液中逐滴滴入NaOH溶液至过量,可观察到的现象是( )
| A、有白色絮状沉淀产生,且不溶解 |
| B、先无现象,后有白色絮状沉淀 |
| C、一直无明显现象 |
| D、先有白色絮状沉淀,后又溶解 |
下列化学变化中,相关示意图错误的是( )
A、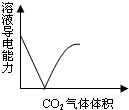 CO2通入澄清石灰水 |
B、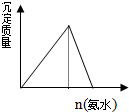 明矾中加入氨水 |
C、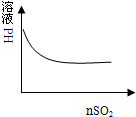 氯水中通入SO2 |
D、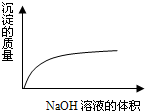 NaOH溶液滴入Ba(HCO3)2溶液 |
相同温度下,在两个等体积的密闭容器中,分别充入氦气、氮气两种气体,当它们的密度都相同时,这两种气体的物质的量之比是( )
| A、7:2 | B、2:7 |
| C、1:7 | D、7:1 |
下列物质中,属于天然高分子化合物的是( )
| A、淀粉 | B、聚乙烯 |
| C、油脂 | D、合成橡胶 |
O2在放电条件下可发生下列反应:3O2
2O3,若放电后混合气体对H2的相对密度为17.8,则氧气转化为臭氧的物质的量分数为( )
| ||
| A、30% | B、25% |
| C、35% | D、90% |

 Ⅰ.化学课上老师演示了如图的实验:
Ⅰ.化学课上老师演示了如图的实验: