题目内容
往AlCl3溶液中逐滴滴入NaOH溶液至过量,可观察到的现象是( )
| A、有白色絮状沉淀产生,且不溶解 |
| B、先无现象,后有白色絮状沉淀 |
| C、一直无明显现象 |
| D、先有白色絮状沉淀,后又溶解 |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,根据物质的溶解性分析解答.
解答:
解:向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,氢氧化铝是难溶性白色物质,偏铝酸钠是可溶性物质,所以看到的现象是:先有白色絮状沉淀,后又溶解.
故选D.
故选D.
点评:本题考查了氯化铝的性质,氯化铝和氢氧化钠溶液反应现象与滴加顺序有关,滴加顺序不同,发生反应现象不同.

练习册系列答案
相关题目
在KHSO4的稀溶液和熔融状态下都存在的离子是( )
| A、H+ |
| B、HSO4- |
| C、SO42- |
| D、K+ |
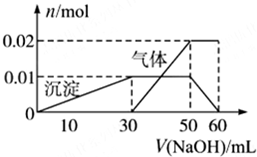 某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:
某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:(1)取10mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀;
(2)取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解.并且随NaOH溶液的加入,沉淀和气体的变化关系如图所示.下列说法不符合事实的是( )
| A、根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B、根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C、另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42-同时完全沉淀 |
| D、NH4+、K+、Al3+、SO42-四种离子的物质的量之比为:2:1:1:3 |
下列实验操作中,错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、用100 mL容量瓶配制90mL1mol/L的NaOH溶液 |
| C、用pH试纸测得新制氯水的pH为2 |
| D、用酸式滴定管准确量取10.00mLKMnO4溶液 |
下列微粒中不能破坏水的电离平衡的是( )
| A、H+ |
| B、OH- |
| C、S2- |
| D、Na+ |







