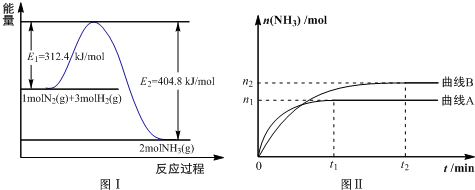
题目内容
18.化学与社会、环境、生活密切相关.下列说法不正确的是( )| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% |
分析 A.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,减少了空气污染物;
B.减少化石燃料使用,可减少颗粒物的排放;
C.生石灰不具有还原性,具有吸水性;
D.依据医用酒精成分解答.
解答 解:A.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,减少了空气污染物,有利于提高空气质量,故A正确;
B.减少化石燃料使用,可减少颗粒物的排放,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量,故B正确;
C.食品包装袋中常放入小袋的生石灰,目的是防止食品受潮,故C错误;
D.医用酒精是用淀粉类植物发酵经蒸馏制成,体积分数通常是75%,故D正确;
故选:C.
点评 本题考查了生活中的化学,熟悉常见的空气污染与治理方法、食品添加剂作用、医用酒精成分是解题关键,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
8.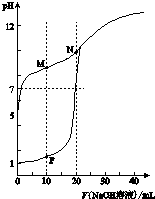 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |
6.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
10.下列关于氧化物及过氧化物的说法中正确的是( )
| A. | 因为H2O2和Na2O2都是过氧化物,所以二者化学键的类型完全相同 | |
| B. | 标准状况下,2.24 L NO2和N2O4组成的混合气体中,原子总数是分子总数的3倍 | |
| C. | NO、NO2、SO2、SO3都是酸性氧化物 | |
| D. | 常温常压下,5.6 L SO2与足量的O2混合,充分反应后,生成的SO3物质的量小于0.25 mol |
7.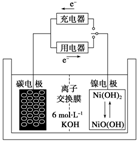 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时离子交换膜每通过4mol离子,碳电极质量减少12g | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将镍电极与电源的负极相连 |
8.乙烯在一定温度、压强下与水反应制备乙醇的过程如下:乙烯$\stackrel{浓H_{2}SO_{4}}{→}$C2H5OSO3H$→_{②}^{H_{2}O}$H2SO4+C2H5OH下列有关说法中错误的是( )
| A. | 反应①是加成反应,反应②是取代反应 | |
| B. | 反应过程中可能会生成污染性气体 | |
| C. | C2H5OSO3H、乙醇均不能使酸性KMnO4溶液褪色 | |
| D. | 若不使用浓硫酸,乙烯仍能与水反应,但反应速率非常慢 |
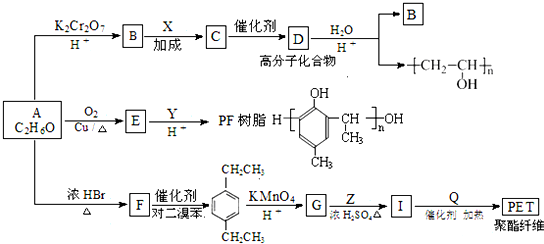
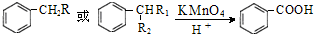 (R为H原子或烃基)
(R为H原子或烃基)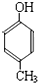
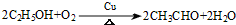
 的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为
的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为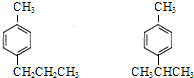

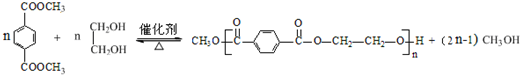 .
. ,请回答下列问题:
,请回答下列问题:
 .
. ;④
;④ .
.