题目内容
10.下列关于氧化物及过氧化物的说法中正确的是( )| A. | 因为H2O2和Na2O2都是过氧化物,所以二者化学键的类型完全相同 | |
| B. | 标准状况下,2.24 L NO2和N2O4组成的混合气体中,原子总数是分子总数的3倍 | |
| C. | NO、NO2、SO2、SO3都是酸性氧化物 | |
| D. | 常温常压下,5.6 L SO2与足量的O2混合,充分反应后,生成的SO3物质的量小于0.25 mol |
分析 A、H2O2中是共价键,Na2O2中既有离子键又有共价键;
B、标准状况下,2.24 L混合气体的物质的量为0.1mol,所以原子总数是分子总数的3倍到6倍;
C、NO不是酸性氧化物;
D、因为常温常压下,5,6 L SO2气体的物质的量一定小于0.25 mol.
解答 解:A、H2O2中是共价键,Na2O2中既有离子键又有共价键,所以化学键类型不完全相同,故A错误;
B、标准状况下,2.24 L混合气体的物质的量为0.1mol,所以原子总数是分子总数的3倍到6倍,而不是3倍,故B错误;
C、NO不是酸性氧化物,故C错误;
D、因为常温常压下,5,6 L SO2气体的物质的量一定小于0.25 mol,而SO2与O2的反应是可逆的,所以生成的SO3物质的量必定小于0.25 mol,故D正确.
故选D.
点评 本题考查化学键、物质的量的计算、氧化物的性质等,注意对每种物质的具体情况进行详细的分析,不能只是以组成类别相似就判定为性质和结构一定相同.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
20.已知温度T时水的离子积常数为Kw.该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的NaOH等体积混合,混合溶液中c(H+)=$\sqrt{{K}_{w}}$mol•L-1.下列说法不正确的是( )
| A. | 混合溶液呈中性 | |
| B. | a≥b | |
| C. | 混合溶液中,c(A-)=c(Na+) | |
| D. | 混合液中水电离出c(OH-)大于该温度下纯水电离出c(OH-) |
1.下列关于二氧化硅的叙述正确的是( )
| A. | 二氧化硅熔点高,硬度大,存在于水泥、陶瓷中 | |
| B. | 二氧化硅用于制造晶体管、集成电路 | |
| C. | 二氧化硅用于制造石英钟表的压电材料和光导纤维 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
18.化学与社会、环境、生活密切相关.下列说法不正确的是( )
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% |
15.下列有机反应类型的判断不正确的是( )
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
2.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
19.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质.X能形成多种单质,其中有两种单质硬度差异极大,下列说法中错误的是( )
| A. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| B. | 化合物Q有强氧化性 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
20.自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
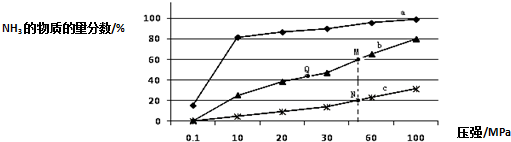
①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.

①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
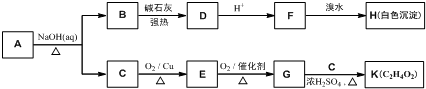

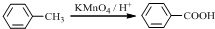
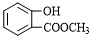 .
.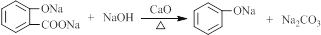 .
.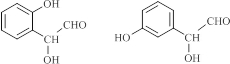 (写结构简式).
(写结构简式).