题目内容
2. 下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).
下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).
(1)元素B位于元素周期表的p(填“s”、“p”或“d”)区.
(2)由A、X、K三种元素中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有
CCl4、PCl3(填分子式).
(3)只含A、E和镍三种元素的晶体具有超导性.该新型超导晶体的一个晶胞如图所示,该晶体的化学式为MgCNi3.
(4)元素D和K形成的化合物中,每个阳离子周围距离最近且相等的阳离子有12个,若该化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{4×58.5}{{a•{N_A}}}$cm3.
分析 根据元素周期表知,A为碳元素,B为氧元素,D为钠元素,E是镁元素,F为硅元素,X为磷元素,K为氯元素,M为镍元素;
(1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称;
(2)根据最外层电子数及形成的共价键数判断8电子稳定结构;
(3)利用均摊法确定晶胞的化学式;
(4)根据氯化钠的晶胞图分析;根据密度和质量计算V=$\frac{m}{ρ}$.
解答 解:A为碳元素,B为氧元素,D为钠元素,E是镁元素,F为硅元素,X为磷元素,K为氯元素,M为镍元素;
(1)氧原子的电子排布式是1s22s22p6,最后填充p电子,所以氧原子位于p区;
故答案为:p区;
(2)由C、P、Cl中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3;
故答案为:CCl4、PCl3;
(3)碳原子位于该晶胞的体心上,所以该晶胞中含有一个碳原子;镁原子个数=8×$\frac{1}{8}$=1,所以该晶胞含有1个镁原子;镍原子个数=6×$\frac{1}{2}$=3,该晶胞中含有3个镍原子,所以该晶胞的化学式为MgCNi3;
故答案为:MgCNi3;
(4)已知氯化钠的晶胞图为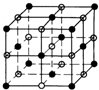 ,晶体中每个Na+周围距离最近且相等的Na+共有12个;
,晶体中每个Na+周围距离最近且相等的Na+共有12个;
该晶胞中钠离子个数=1+12×$\frac{1}{4}$=4,氯离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以1个氯化钠晶胞中含有4个氯化钠,晶胞的体积V=$\frac{m}{ρ}$=$\frac{4×58.5}{{a•{N_A}}}$cm3;
故答案为:12; $\frac{4×58.5}{{a•{N_A}}}$.
点评 本题是对物质结构的考查,涉及元素周期表、核外电子排布、晶胞结构计算等,难度中等,注意识记中学常见晶胞结构.

| A. | 一定含有甲烷 | B. | 一定含有乙烯 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 一定含有乙烯,不一定含有甲烷 |
| A. | 12和8 | B. | 6和8 | C. | 12和17 | D. | 20和16 |
| A. | 乙烯可使溴的四氯化碳溶液褪色 | B. | 乙醇难溶于水,密度比水小 | ||
| C. | 氧化镁用于电解冶炼单质镁 | D. | 二氧化硅用于制造太阳能电池 |
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅只含有铁元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
| A. | NaOH 溶液 | B. | NaCl 溶液 | C. | KSCN 溶液 | D. | 氨水 |
| A. | 溶液中只有一种阴离子(OH-除外) | B. | 溶液中溶质的物质的量之比为1:2 | ||
| C. | 反应后有CO2逸出 | D. | 反应后的溶液还可以吸收部分CO2 |
 .
. .
. .
.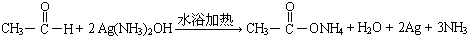 .
.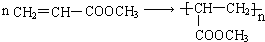 .
.