题目内容
(1)A元素的负二价离子和B元素的正一价离子的电子层结构都与氖相同,A的离子的电子排布式为 ;由A、B两元素形成的化合物化学式为 ,该物质所含化学键类型为 ,晶体类型为 晶体.
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则三元素的第一电离能由小到大的顺序为 (填元素符号),其原因是
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有(填元素符号,任写两种) .
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则三元素的第一电离能由小到大的顺序为
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有(填元素符号,任写两种)
考点:原子核外电子排布,元素电离能、电负性的含义及应用
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:(1)A元素的负二价离子和B元素的正一价离子的电子层结构都与氖相同,则A为氧元素,B为钠元素,据此答题;
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则D为碳元素,E为氮元素,F为氧元素,根据元素周期律判断第一电离能大小;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的核外电子排布式为1s22s22p63s23p63d104s1,据此确定外围电子排布式;
(4)根据原子核外电子排布特征和元素所在周期判断;
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则D为碳元素,E为氮元素,F为氧元素,根据元素周期律判断第一电离能大小;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的核外电子排布式为1s22s22p63s23p63d104s1,据此确定外围电子排布式;
(4)根据原子核外电子排布特征和元素所在周期判断;
解答:
解:(1)A元素的负二价离子和B元素的正一价离子的电子层结构都与氖相同,则A为氧元素,B为钠元素,氧离子的电子排布式为1s22s22p6,A、B两元素形成的化合物化学式为Na2O,该化合物中含有离子键,形成离子晶体,故答案为:1s22s22p6;Na2O;离子键;离子;
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则D为碳元素,E为氮元素,F为氧元素,根据元素周期律,在同周期中,从左向右,元素第一电离能逐渐增大,但由于第ⅤA族最外层电子是半充满状态,是一种稳定结构,所以第一电离能都高于相邻周期的元素,故C、N、O的第一电离能顺序为C<O<N,
故答案为:C<O<N;在同周期中,从左向右,元素第一电离能逐渐增大,但由于第ⅤA族最外层电子是半充满状态,是一种稳定结构,所以第一电离能都高于相邻周期的元素;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的核外电子排布式为1s22s22p63s23p63d104s1,所以外围电子排布式为3d104s1,故答案为:3d104s1;
(4)根据元素周期表,在第一周期中氢元素未成对电子数是1,第二周期中未成对电子数是2的有碳元素和氧元素,第三周期中未成对电子数是3的有磷元素,故答案为:H、C、O、P;
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则D为碳元素,E为氮元素,F为氧元素,根据元素周期律,在同周期中,从左向右,元素第一电离能逐渐增大,但由于第ⅤA族最外层电子是半充满状态,是一种稳定结构,所以第一电离能都高于相邻周期的元素,故C、N、O的第一电离能顺序为C<O<N,
故答案为:C<O<N;在同周期中,从左向右,元素第一电离能逐渐增大,但由于第ⅤA族最外层电子是半充满状态,是一种稳定结构,所以第一电离能都高于相邻周期的元素;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的核外电子排布式为1s22s22p63s23p63d104s1,所以外围电子排布式为3d104s1,故答案为:3d104s1;
(4)根据元素周期表,在第一周期中氢元素未成对电子数是1,第二周期中未成对电子数是2的有碳元素和氧元素,第三周期中未成对电子数是3的有磷元素,故答案为:H、C、O、P;
点评:本题主要考查根据原子结构推断元素、进而考查第一电离能、外围电子排布、原子结构等知识,难度不大,注重基础知识的考查.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
自然界地表层铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS,慢慢转变为CuS.下列分析正确的是( )
| A、铜的硫化物具有氧化性 |
| B、CuS的溶解度大于ZnS的溶解度 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D、以上过程涉及到了氧化还原反应和复分解反应 |
将一定量xAl2(SO4)3?y(NH4)2SO4?24H2O晶体加入到过量NaOH溶液中,加热生成NH3 0.85g(假如生成的NH3全部逸出),再通入过量的CO2,过滤、洗涤、灼烧,得Al2O3固体2.55g.则x:y=(已知:Al2O3的相对分子质量为102;NH3的相对分子质量为17)( )
| A、1:2 | B、1:1 |
| C、1:4 | D、2:1 |
最外层为N层的基态原子中,未成对的电子数目最多为( )个.
| A、4 | B、5 | C、6 | D、7 |
价电子满足4s和3d为半满的元素是( )
| A、Ca | B、V | C、Cr | D、Cu |
某有机物其结构简式如图关于该有机物,下列叙述不正确的是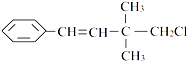 ( )
( )
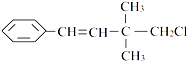 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
下列关于淀粉、脂肪、蛋白质的说法中错误的是( )
| A、它们都是生活中常见的高分子化合物 |
| B、它们都是有机化合物 |
| C、它们在一定条件下都能发生水解反应 |
| D、它们都是生物体进行生命活动的能源 |