题目内容
 有A、B、C、D、E五种元素,其相关信息如下:
有A、B、C、D、E五种元素,其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
(1)写出元素E的基态原子的电子排布式
(2)CA3分子中C原子的杂化类型是
(3)C与A还可形成C2A4、CA5等化合物,二者都能与盐酸反应.则C2A4与盐酸反应的离子方程式为
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为
a.平面正方形 B.正四面体 c.三角锥形D.V形
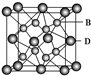
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为
考点:晶胞的计算,原子核外电子排布,位置结构性质的相互关系应用,化学键,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,元素周期律与元素周期表专题,化学键与晶体结构
分析:A原子的1s轨道上只有1个电子,应为H元素,B是电负性最大的元素,为F元素;C基态原子的2p轨道中有3个未成对电子,为N元素;E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子,应为Cu元素,D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子,则位于第四周期,最外层电子数为2,为Ca元素,以此解答该题.
解答:
解:A原子的1s轨道上只有1个电子,应为H元素,B是电负性最大的元素,为F元素;C基态原子的2p轨道中有3个未成对电子,为N元素;E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子,应为Cu元素,D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子,则位于第四周期,最外层电子数为2,为Ca元素,
(1)E为Cu,原子序数为29,核外电子排布为[Ar]3d104s1,故答案为:[Ar]3d104s1;
(2)CA3分子为NH3,N原子形成3个δ键,且孤对电子数为
=1,为sp3杂化,在元素Cu的硫酸盐溶液中逐渐通入NH3,首先发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,可观察到蓝色沉淀生成,氨气过量,然后发生Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,沉淀溶解,得到蓝色溶液,
故答案为:sp3杂化;先有蓝色沉淀产生,然后沉淀逐渐溶解得到深蓝色溶液;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(3)N2H4与盐酸反应的离子方程式为N2H4+2H+=[N2H6]2+,NH5还可与水反应产生无色气体,且所得溶液显碱性,发生NH4H+H2O=NH3?H2O+H2↑,NH5的电子式为 ,
,
故答案为:N2H4+2H+=[N2H6]2+; ;NH4H+H2O=NH3?H2O+H2↑;
;NH4H+H2O=NH3?H2O+H2↑;
(4)H、N、Cu三种元素可形成的[Cu(NH3)4]2+,为配合物,含有极性共价键和配位键,Cu形成4个δ键,且存在12个N-H键,在1mol该物质含有16NA(或16×6.02×1023)个σ键,当[Cu(NH3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,说明为平面型结构,如为正四面体,则不存在同分异构体,
故答案为:①③;16NA(或16×6.02×1023);a;
(5)晶胞中F为晶胞内部,晶胞中含有8个F-离子,Ca2+离子位于顶点与面心,晶胞中含有Ca2+离子数目为8×
+6×
=4,故该晶胞的化学式为CaF2,以晶胞中上面心Ca2+离子为研究对象,晶胞中没个Ca周围最近的F-离子有8个,Ca离子配位数为8,
故答案为:8;CaF2.
(1)E为Cu,原子序数为29,核外电子排布为[Ar]3d104s1,故答案为:[Ar]3d104s1;
(2)CA3分子为NH3,N原子形成3个δ键,且孤对电子数为
| 5-3 |
| 2 |
故答案为:sp3杂化;先有蓝色沉淀产生,然后沉淀逐渐溶解得到深蓝色溶液;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(3)N2H4与盐酸反应的离子方程式为N2H4+2H+=[N2H6]2+,NH5还可与水反应产生无色气体,且所得溶液显碱性,发生NH4H+H2O=NH3?H2O+H2↑,NH5的电子式为
 ,
,故答案为:N2H4+2H+=[N2H6]2+;
 ;NH4H+H2O=NH3?H2O+H2↑;
;NH4H+H2O=NH3?H2O+H2↑;(4)H、N、Cu三种元素可形成的[Cu(NH3)4]2+,为配合物,含有极性共价键和配位键,Cu形成4个δ键,且存在12个N-H键,在1mol该物质含有16NA(或16×6.02×1023)个σ键,当[Cu(NH3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,说明为平面型结构,如为正四面体,则不存在同分异构体,
故答案为:①③;16NA(或16×6.02×1023);a;
(5)晶胞中F为晶胞内部,晶胞中含有8个F-离子,Ca2+离子位于顶点与面心,晶胞中含有Ca2+离子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:8;CaF2.
点评:本题考查了物质、结构与性质的应用以及晶胞的计算,题目难度中等,根据题干信息及所学知识正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题能力.

练习册系列答案
相关题目
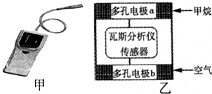 瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极b流向电极a |
| C、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D、当固体电解质中有1 molO2-通过时,电子转移2 mol |
下列各组离子一定能大量共存的是( )
| A、在无色溶液中:NH4+、Fe2+、SO42-、CO32- |
| B、加铝粉产生氢气的溶液中:NH4+、NO3?、Cl?、Ba2+ |
| C、在pH=1的溶液中:K+、Fe2+、Cl-、CH3COO- |
| D、含有0.1 mol?L-1H2SO4的溶液中:K+、Mg2+、Cl-、NO3- |
两份体积相同的某植物营养液,其配方如下:①②两份营养液的成分(所含离子)( )
| 成分 含量 编号 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| ① | 0.3mol | 0.2mol | 0.1mol | - |
| ② | 0.1mol | 0.3mol | - | 0.1mol |
| A、仅n(K+)相同 |
| B、仅n(Cl-)相同 |
| C、不完全相同 |
| D、完全相同 |
用盐酸测定碳酸钠时既可用酚酞作指示剂又可用甲基橙(一种酸碱指示剂)作指示剂,现分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,下列说法中不正确的是( )
| A、用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl═NaHCO3+NaCl |
| B、用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl═NaCl+CO2↑+H2O |
| C、可用碱式滴定管量取所需要的Na2CO3溶液 |
| D、若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低 |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、酸与碱恰好完全反应生成正盐的溶液 |
| C、使石蕊试液呈紫色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L溶液 |