题目内容
20.下列电离方程式中正确的是( )| A. | HNO3═H++N5++3O2- | B. | Ca(OH)2═Ca2++(OH-)2 | ||
| C. | AlCl3═Al+3+3Cl- | D. | Al2(SO4)3═2Al3++3SO42- |
分析 A.硝酸为强电解质,完全电离出氢离子与硝酸根离子;
B.氢氧根离子不能合写;
C.铝离子书写错误;
D.硫酸铝为强电解质,完全电离.
解答 解:A.硝酸为强电解质,完全电离出氢离子与硝酸根离子,电离方程式:HNO3═H++NO3-,故A错误;
B.氢氧化钙为强电解质,完全电离,电离方程式:Ca(OH)2═Ca2++2OH-,故B错误;
C.氯化铝为强电解质,水溶液中完全电离,电离方程式:AlCl3═Al3++3Cl-,故C错误;
D.硫酸铝为强电解质,水溶液中完全电离出铝离子、硫酸根离子,电离方程式:Al2(SO4)3═2Al3++3SO42-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式书写,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循客观事实、遵循原子个数、电荷数守恒规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.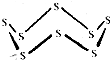 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 还原产物为CO2 |
11.以下反应可以用熵判据来解释的是( )
| A. | 0℃时水结冰 | |
| B. | CaO(s)+CO2(g)═CaCO3(s)△H=-175.7kJ/mol | |
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
8.下列叙述正确的是( )
| A. | 需要加热的反应说明它是吸热反应 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
15.有NaCl、MgCl2、AlCl3、FeCl2、FeCl3、CuCl2、NH4Cl七种溶液,只用一种试剂(必要时可加热)就可把它们鉴别开来,这种试剂是( )
| A. | 盐酸 | B. | KSCN溶液 | C. | 氨水 | D. | 烧碱溶液 |
5.关于如图所示①、②两个装置的叙述中,正确的是( )
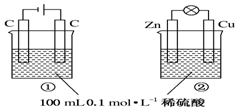

| A. | 硫酸浓度变化:①增大,②减小 | |
| B. | 装置名称:①是原电池,②是电解池 | |
| C. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑②中正极:Zn-2e-═Zn2+ | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
12.下列混合物能用过滤法分离的是( )
| A. | 酒精和水 | B. | 食盐和蔗糖 | C. | 泥沙和食盐水 | D. | 铜粉和铝粉 |
9.下列叙述正确的是( )
| A. | 2 mol H2O的质量为36g/mol | B. | CH4的摩尔质量16 | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 1 mol任何物质体积均为22.4L |
10.同周期的X、Y、Z三种元素,最高价氧化物的水化物酸性从强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
| A. | .原子半径X>Y>Z | |
| B. | .非金属性 X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | .阴离子的还原性按X、Y、Z顺序由强到弱 |