题目内容
下列有关铜锌原电池(如图)的叙述正确的是( )


| A、正极反应为Zn-2e-═Zn2+ |
| B、取下盐桥,原电池仍可工作 |
| C、在外电路中,电子从正极流向负极 |
| D、电池反应为Zn+Cu2+═Zn2++Cu |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,以此解答该题.
解答:
解:A.正极反应为Cu2++2e-=Cu,故A错误;
B.撤去盐桥,不能形成闭合回路,则不能形成原电池反应,故B错误;
C.电子从电池负极经外电路流向正极,故C错误;
D.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故D正确.
故选D.
B.撤去盐桥,不能形成闭合回路,则不能形成原电池反应,故B错误;
C.电子从电池负极经外电路流向正极,故C错误;
D.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故D正确.
故选D.
点评:本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大.

练习册系列答案
相关题目
下列有关化学与生活说法中,不正确的是( )
A、 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B、大量生产聚乙烯、聚氯乙烯一次性超薄袋,方便日常生活 |
| C、75%的乙醇溶液常用来消毒,是因为酒精能够使细菌蛋白质发生变性 |
| D、页岩气是从页岩层中开采出来的天然气.由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
碘是一种与人的生命活动密切相关的元素,已知I2能溶于NaOH或KI溶液,反应方程式分别为:3I2+6OH-═5I-+IO
+3H2O(HIO不稳定,易发生歧化反应)和I2+I-═I
,溴化碘(IBr)是一种卤素互化物,具有与卤素单质相似的性质,下列反应方程式中不正确的是( )
- 3 |
- 3 |
| A、IBr加入Na2S溶液中产生黄色浑浊:IBr+S2-═I-+Br-+S↓ | ||
B、IBr加入KI溶液中:IBr+2I-═Br-+I
| ||
| C、IBr加入NaOH溶液中:IBr+2OH-═BrO-+I-+H2O | ||
D、IBr加入AgNO3溶液中:3IBr+5Ag++3H2O═3AgBr↓+2AgI↓+IO
|
已知化学反应:C(s)+
O2(g)═CO(g)△H1<0CO(g)+
O2(g)═CO2(g)△H2<0C(s)+O2(g)═CO2(g)△H3<0;下列说法不正确的是(相同条件下)( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量 |
| B、12gC所具有的能量一定大于28gCO所具有的能量 |
| C、△H1+△H2>△H3 |
| D、将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
下列说法正确的是( )
| A、常温下,NaCl(aq)+H2O(1)+CO2(g)+NH3(g)═NaHCO3(s)+NH4Cl(aq)能自发进行,则该反应的△H<0 |
| B、在等浓度NaCl和KI溶液中滴加AgNO3溶液,先产生白色沉淀 |
| C、等物质的量浓度的HA与NaA溶液等体积混合后,混合溶液不一定显酸性 |
| D、对于某△H<0的反应,加热能使该反应的反应速率和平衡常数均增大 |
下列各组元素性质的递变情况错误的是( )
| A、P、S、Cl元素最高正价依次升高 |
| B、N、O、F第一电离能依次增大 |
| C、Na、Mg、Al原子最外层电子数依次增多 |
| D、Na、K、Rb电负性逐渐减小 |
下列有关化学用语表示正确的是( )
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3═Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: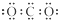 |