题目内容
有两条途径可以使重晶石(BaSO4)转化为碳酸钡,如图所示:
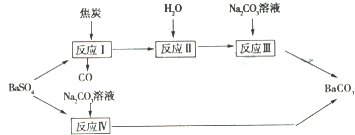
试回答下列问题:
(l)反应I 中发生的主要反应为:BaSO4+4C=BaS+4CO,若1mol BaSO4 完全反应,电子转移的物质的量为 ;
(2)Na2CO3 溶液的pH 大于10,用离子方程式说明其主要原因 ,其溶液中离子浓度由大到小的顺序是 ;
(3)已知反应IV 中发生的反应为:BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,写出此反应平衡常数表达式K= ;若KSP(BaSO4)为1×10-10mol2.L-2,KSP(BaCO3)为5×10-9mol2.L-2,则K 的值为 ;
(4)若每次加入1L 2mol?L-1的Na2CO3溶液,至少需要 次可以将0.2mol BaSO4转化为BaCO3.

试回答下列问题:
(l)反应I 中发生的主要反应为:BaSO4+4C=BaS+4CO,若1mol BaSO4 完全反应,电子转移的物质的量为
(2)Na2CO3 溶液的pH 大于10,用离子方程式说明其主要原因
(3)已知反应IV 中发生的反应为:BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,写出此反应平衡常数表达式K=
(4)若每次加入1L 2mol?L-1的Na2CO3溶液,至少需要
考点:盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,离子浓度大小的比较
专题:盐类的水解专题
分析:(1)依据化学方程式中元素化合价变化分析计算电子转移;
(2)Na2CO3 溶液的pH 大于10,说明溶液显碱性,碳酸根离子分步水解的原因;依据溶液中离子浓度比较大小;
(3)已知反应IV 中发生的反应为:BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,平衡常数概念书写,同一溶液中钡离子浓度相同,结合溶度积常数表达式推算K;
(4)若每次加入1L 2mol?L-1的Na2CO3溶液,结合BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,的平衡常数计算生成硫酸根离子物质的量得到将0.2mol BaSO4转化为BaCO3的次数;
(2)Na2CO3 溶液的pH 大于10,说明溶液显碱性,碳酸根离子分步水解的原因;依据溶液中离子浓度比较大小;
(3)已知反应IV 中发生的反应为:BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,平衡常数概念书写,同一溶液中钡离子浓度相同,结合溶度积常数表达式推算K;
(4)若每次加入1L 2mol?L-1的Na2CO3溶液,结合BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,的平衡常数计算生成硫酸根离子物质的量得到将0.2mol BaSO4转化为BaCO3的次数;
解答:
解:(l)BaSO4+4C=BaS+4CO,碳元素化合价0价变化为+2价,电子转移8e-,若1mol BaSO4 完全反应,电子转移的物质的量为8mol;
故答案:8mol;
(2)Na2CO3 溶液的pH 大于10,说明溶液显碱性,碳酸根离子分步水解的原因CO32-+H2O?HCO3-+OH-; HCO3-+H2O?H2CO3+OH-,溶液中离子浓度大小为:c( Na+)>c( CO32-)>c( OH-)>c( HCO3-)>c ( H+ );
故答案为:CO32-+H2O?HCO3-+OH-; c( Na+)>c( CO32-)>c( OH-)>c( HCO3-)>c ( H+ );
(3)已知反应IV 中发生的反应为:BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,写出此反应平衡常数表达式K=
,同一种溶液中钡离子浓度相同,K=
=
=
=0.02
故答案为:
;0.02;
(4)若每次加入1L 2mol?L-1的Na2CO3溶液,能处理BaSO4物质的量xmol
BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,
2.0-x x
K=
=
=0.02
x=5.1,所以至少6次可以将0.2mol BaSO4转化为BaCO3.
故答案为:6.
故答案:8mol;
(2)Na2CO3 溶液的pH 大于10,说明溶液显碱性,碳酸根离子分步水解的原因CO32-+H2O?HCO3-+OH-; HCO3-+H2O?H2CO3+OH-,溶液中离子浓度大小为:c( Na+)>c( CO32-)>c( OH-)>c( HCO3-)>c ( H+ );
故答案为:CO32-+H2O?HCO3-+OH-; c( Na+)>c( CO32-)>c( OH-)>c( HCO3-)>c ( H+ );
(3)已知反应IV 中发生的反应为:BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,写出此反应平衡常数表达式K=
| c(SO42-) |
| c(CO32-) |
| c(SO42-)c(Ba2+) |
| c(CO32-)c(Ba2-) |
| KSp(BaSO4) |
| Ksp(BaCO3) |
| 1×10-10 |
| 5×10-9 |
故答案为:
| c(SO42-) |
| c(CO32-) |
(4)若每次加入1L 2mol?L-1的Na2CO3溶液,能处理BaSO4物质的量xmol
BaSO4 ( s )+CO3 2-?BaCO3 ( s )+SO42-,
2.0-x x
K=
| c(SO42-) |
| c(CO32-) |
| x |
| 2.0-x |
x=5.1,所以至少6次可以将0.2mol BaSO4转化为BaCO3.
故答案为:6.
点评:本题考查了沉淀溶解平衡的计算分析应用,电解质溶液中离子浓度大小比较分析,氧化还原反应、电子转计算,掌握基础是关键,题目难度中等.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
下列关于有机物的说法错误的是( )
| A、乙烯使溴水退色是因为发生了加成反应 |
| B、糖类、油脂、蛋白质都可以水解 |
| C、只用水就可以鉴别四氯化碳、苯和乙醇 |
| D、石油分馏是物理变化、煤干馏是化学变化 |
氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法正确的是( )
| A、Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 |
| B、1L浓度为l mol?L-1的NH4Cl溶液中含有NA个NH4+ |
| C、除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D、不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性 |
下列物质的稀溶液中,溶质的阴、阳离子个数之比为2:1的是( )
| A、Na2HPO4 |
| B、NaHSO4 |
| C、(NH4)2SO4 |
| D、K2S |
常温时,下列溶液的pH等于8或大于8的是( )
| A、0.1 mol?L-1的NaCl溶液 |
| B、pH=6的醋酸用水稀释100倍 |
| C、pH=10的氢氧化钠溶液稀释1000倍 |
| D、0.1 mol?L-1的硫酸100 mL跟0.2 mol?L-1 NaOH溶液150 mL完全反应 |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、2.7g金属铝变成铝离子时,失去的电子数为0.1NA |
| B、常温常压下,NA个氮分子的质量为28g |
| C、8g甲烷中所含氢原子数为2NA |
| D、100mL2mol/L氯化铝溶液中含Cl-离子数为0.2NA |
氧气的摩尔质量为( )
| A、32g |
| B、32mol |
| C、32 |
| D、32 g/mol |